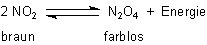
Das Gasgleichgewicht NO2/N2O4
Experimente:
Versuch: Gasreaktionsgleichgewichte: Das NO2/N2O4-Gleichgewicht
Wenn man Stickstoffdioxid NO2 herstellt, muss man sich darüber klar sein, dass man
im Auffanggefäß zwei Gase nebeneinander vorliegen hat: Das braune NO2 bildet leicht ein
farbloses Dimeres, Distickstofftetroxid N2O4.
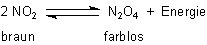
Grund für die unterschiedliche Farbigkeit ist, dass es sich beim NO2 um eine
radikalische Verbindung handelt und beim N2O4 nicht. Beim NO2 sind die
Elektronen bereits durch sichtbares Licht anregbar, so dass sie aus diesem
Spektralbereich den zur beobachteten Farbe komplementären Lichtanteil
absorbieren. Beim N2O4 befinden sich die Elektronen alle in so stabilen Zuständen,
dass sie nur durch UV-Strahlung angeregt werden können.
Die Radikaleigenschaft ist auch Grund für die Bildung von nichtradikalischem N2O4.
Denn ein Radikal ist weniger stabil und versucht, seine halbgefüllte
Elektronenschale aufzufüllen - zum Beispiel durch Dimerisierung. Das machen
auch die Chloratome bei der Elektrolyse von Natriumchlorid.
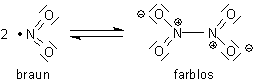
Dabei bildet sich ein Gleichgewicht aus. Den Dissoziationsgrad bzw. die Konzentrationen kann man spektroskopisch bestimmen.
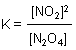
Das folgende Bild zeigt schematisch, wie eine Gleichgewichtsmischung bei verschiedenen Temperaturen aussieht.
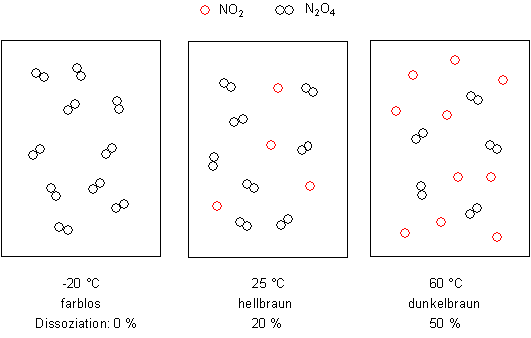
Bei 25 °C sind erst 20 % der Dimeren dissoziiert. Damit bestehen immerhin 66,7 Vol% des vorliegenden "braunen" Gases
aus farblosen N2O4-Molekülen! Damit werden zum Beispiel quantitative Berechnungen zur NOx-Belastung
der Atmosphäre stark erschwert.
Anhand des NO2/N2O4-Gasgleichgewichts kann man hervorragend die Prinzipien
von Le Chatelier nachvollziehen. Das ist möglich, weil auf der linken und der rechten Seite der o. a. Reaktionsgleichung die
Molzahl der Gase verschieden ist. Hier geht es vor allem um Änderungen von Druck und Temperatur.
Man mag einwenden, dass man diese Prinzipien besser anhand der sowieso wichtigeren Ammoniaksynthese herleiten sollte. Das NO2/N2O4-Gasgleichgewicht hat jedoch den Vorteil, dass es sich zumindest qualitativ leicht experimentell erschließen lässt (-> Versuch).
Mit Hilfe eines Kolbenprobers kann man das Verhalten der Gleichgewichtsmischung bei Druckänderung demonstrieren. Man sieht, dass sich das Gas beim Komprimieren völlig unerwartet aufhellt, während es beim Expandieren dunkel wird.
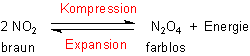
(Genau genommen ändert sich aufgrund des Energieumsatzes auch die Temperatur etwas, was sich aber nicht auf die Aussagekraft des Experiments auswirkt.)
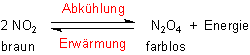
Zur Untersuchung der Auswirkung von Temperaturänderungen füllt man das Gas in Ampullen. Diese kühlt man ab oder erwärmt sie. Anhand der Farbänderungen kann man zeigen, dass das Gleichgewicht beim Abkühlen nach rechts, beim Erwärmen nach links verschoben wird.
Am besten vergleicht man das Verhalten der Stickstoffoxid-Gasmischung mit den Aggregatszustandsänderungen von Bromdampf. (Die Schüler vermuten anfangs bei der Demonstration des Gases sowieso, dass es sich um Brom handeln müsse.) Bromdampf wird beim Komprimieren flüssig und bei starkem Abkühlen in einer Kältemischung sogar fest, während die Stickoxidmischung gasförmig bleibt und nur farblos wird.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“