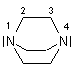
Fragen zur Synthese der Polyurethane
Experimente:
Versuch: Polyurethan auf der Basis von Kohlenhydraten
Versuch: Polyurethan auf der Basis von Lignin
Versuch: Reaktion von Huminsäuren mit Diisocyanaten
In der Webseite Kunststoffe auf der Basis von nachwachsenden Rohstoffen
haben wir u. a. die Experimente beschrieben, wie Polyurethane (PUR) hergestellt werden können. Dabei
stellen sich erfahrungsgemäß immer wieder die gleichen Fragen.
Was ist die Struktur des Aktivators?
Der Aktivator 1,4-Diazabicyclo[2.2.2]octan heißt auch Triethyldiamin.
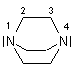
Wie kommt er zu seinem IUPAC-Namen?
Zunächst denken wir uns einen formalen Kohlenwasserstoff, der das gesamte
s-Bindungsgerüst bildet - hier Octan. Davon sind
zwei C-Atome durch N-Atome ersetzt - also der Zusatz Diaza. Deren Positionen sind
1 und 4. Im Molekül sind zwei Ringe ausgebildet - also
bicyclo. Von der Stellung 2 geht jeweils die Ringbildung aus - [2.2.2].
Zum guten alten Namen "Triethyldiamin": Ethyl steht für die (-CH2-CH2-)-Gruppe.
Welche Rolle spielt der Aktivator überhaupt?
Er wirkt als Basenkatalysator. Bei der Synthese der Polyurethane wird ein Alkohol mit dem Isocyanat
umgesetzt. Es bildet sich dabei ein gemischtes Amid/Ester-System, eben das Urethan.
Nun muss zur PUR-Bildung bei der Additionsreaktion das Proton der OH-Gruppe des zu addierenden Alkohols
zum N-Atom des Isocyanats wandern. Gleichzeitig wird das O-Atom an das C-Atom andocken. Da die Basizität des
N-Atoms zu gering ist, muss das Proton anders gelockert werden. Das geschieht durch das stark basische
N-Atom des Triethyldiamins.
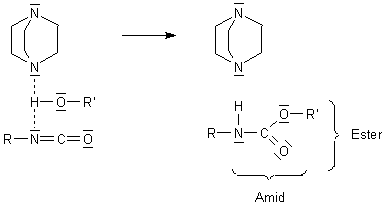
Das Triethylamin reagiert als tertiäres Amin wegen des (+I)-Effekts der Ethylenbrücken als besonders starke Base. Wichtig ist auch, dass es sich wegen des großen Kohlenwasserstoff-Anteils gut in dem hydrophoben Reaktionsgemisch löst.
Warum schäumen manche Reaktionsmischungen und manche nicht?
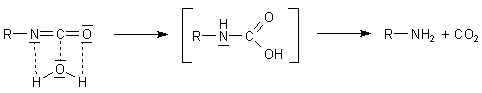
Normalerweise ist PUR eine glasartige Substanz. Manchmal schäumt ein Gas den Kunststoff auf. Es handelt sich
um CO2. Sein Ursprung: Wasser reagiert mit der Isocyanat-Komponente rasch zu Carbamidsäure. Diese zerfällt
als freie Säure spontan zu einem Amin und CO2. Diese Eigenschaft der freien Carbamidsäure spielt übrigens
auch eine wichtige Rolle bei der Urease-Reaktion. Von der Carbamidsäure sind nur
ihre Ester stabil. Das sind die Urethane.
Früher mischte man deshalb zum Aufschäumen von PUR zur Reaktionsmischung immer etwas Wasser hinzu.
Wenn jedoch die Ausgangsstoffe von vornherein wasserhaltig sind, geht das Aufschäumen auch ohne Wasserzusatz. In unseren Experimenten ist das zunächst einmal die Glucose, die immer mindestens als Monohydrat vorliegt. Ähnliches gilt für Stärke und in gewissem Umfang auch für Saccharose.
Warum muss man mit giftigem Dimethylformamid arbeiten?
Die Substanz (T) ist giftig. Warum nutzt man sie - vor allem, wenn es um nachwachsende Rohstoffe geht?
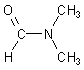
Dimethylformamid (DMF)
Wir holen zur Beantwortung etwas weiter aus: Bei der Synthese von PUR müssen die Edukte gelöst oder zumindest gequollen oder als Emulsion vorliegen. Kohlenhydrate wie Saccharose sind normalerweise aber nur in Wasser oder in einfachen Alkoholen (wie Methanol, Ethanol oder Propanol) löslich. Damit sind die Probleme vorprogrammiert:
| - | Einfache Alkohole konkurrieren mit den mehrfunktionellen Alkoholen, so dass sich kaum polymeres Urethan (PUR) bildet. |
| - | Wasser hydrolysiert das Diisocyanat - wie oben erklärt. |
Statt einem stabilen Kunststoff gibt es nur lockeren Schaum.
Dimethylformamid (Abkürzung DMF) dagegen löst nicht nur Kohlenhydrate, sondern vermischt sich auch gut mit dem unpolaren Diisocyanat und mit dem Aktivator.
Weitere Texte zum Thema „Nachwachsende Rohstoffe“