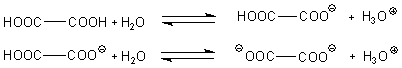
Säure/Base-Eigenschaften der Oxalsäure
Experimente
Versuch: pH-Wert-Messung von Oxalsäure- und Oxalatlösungen
Versuch: Maßanalytische Säure/Base-Titration der Oxalsäure
Versuch: Potentiometrische Säure/Base-Titrationskurve von Oxalsäure
Die Oxalsäure ist eine zweibasische Säure, kann also zwei Protonen freisetzen. Entsprechend
gibt es zwei Säure/Base-Gleichgewichte.
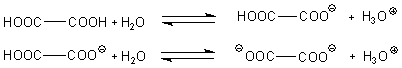
Die zugehörigen pKa-Werte sind 1,46 und 4,40. Damit wirkt die erste Stufe der Oxalsäure saurer als Ameisensäure (-> pKa = 3,75). Sie steht in der Säurestärke nahe bei den schwächeren Mineralsäuren.
Die erstaunliche Säurestärke der Oxalsäure, dokumentiert durch den niedrigen ersten pKa-Wert, hat die Ursache im (-I)-Effekt, den die beiden Carboxylgruppen aufeinander ausüben.
Der zweite, höhere pKa-Wert weist dagegen auf eine geringere Acidität der zweiten Carboxylgruppe. Der Grund: Protonen sind positiv geladen. Eine zweite positive Ladung von einer bereits vorhandenen negativen Ladung zu trennen, ist schwer, vor allem, weil das Oxalsäuremolekül so klein ist. Hinzu kommt noch erschwerend, dass sich zwischen den beiden Carboxylresten eine relativ stabile H-Brücke ausbildet.
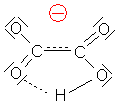
Dissoziation und H-Brückenbildung bei der Oxalsäure
Als zweibasische Säure bildet die Oxalsäure zwei Reihen von Salzen: Normale und saure Salze (Hydrogensalze).
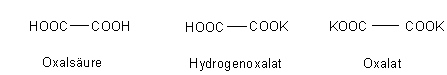
Berechnung des pH-Werts einer Oxalsäurelösung
Zur Berechnung geht man von der Henderson-Hasselbalchschen Gleichung aus. Zur Vereinfachung nimmt man an,
dass der dissoziierte Anteil der schwachen Säure gegenüber der Gesamtkonzentration c vernachlässigbar
klein ist. Wegen der großen Differenz der zwei pKa-Werte vernachlässigen wir auch die Dissoziation
der zweiten Stufe.
pH = ½ (pKa - log c)
Beispiel: Welches ist der pH-Wert einer Oxalsäurelösung (c = 0,1 mol/l)? Der pKa-Wert der Oxalsäure ist 1,46.
pH = ½ (1,46 - log 0,1) = ½ (1,46 + 1) = 1,23
(Zu den Hintergründen und weiteren Berechnungen dieser Art lies hier.)
Maßanalytische Säure/Base-Titrationen der Oxalsäure
Die folgende Auswertungsgleichung ist das so genannte "Chemische Hebelgesetz".
Wir legen allgemein a ml Säurelösung vor und geben bis zum Umschlagspunkt des Indikators mit b ml Natronlauge zu.
a ml · c(Säure) mol/l = b ml · c(NaOH) mol/l
Zur Auswertung der klassischen Säure/Base-Titration muss man jedoch bedenken, dass die Oxalsäure zweibasisch ist. 1 Mol Oxalsäure ist 2 Mol Natronlauge äquivalent. Deshalb versehen wir die Oxalsäurekonzentration mit dem "Normal-Faktor" 2.
a ml · 2 · c(Oxalsäure) mol/l = b ml · c(NaOH) mol/l
Wenn man so will, ist es ein "gewichtetes Hebelgesetz". Denn die Oxalsäure "drückt doppelt so stark" wie die Natronlauge.
c(Oxalsäure) mol/l = 1/2 (b/a) · c(NaOH) mol/l
In unserem Beispiel haben wir 25 ml Oxalsäure vorgelegt und 50 ml Natronlauge verbraucht. Damit sind beide Lösungen 1-molar.
Potentiometrische Säure/Base-Titrationskurve
Wenn man nach jeder Zugabe an Natronlauge mit einem pH-Meter den pH-Wert misst, erhält man die Daten für eine
potentiometrische Titrationskurve (-> Versuch).
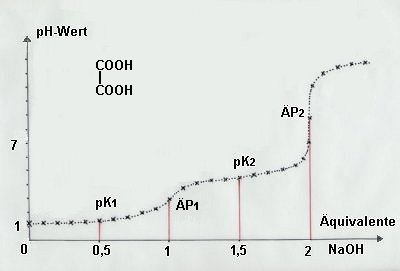
Titrationskurve der Oxalsäure (Daten siehe Versuch)
Da die Oxalsäure eine zweibasische Säure ist, sollte man in der Titrationskurve zwei Wendepunkte finden, die den pH-Werten entsprechen, bei denen die pKa-Werte liegen. Dazwischen liegt der pH-Wert des ersten Äquivalenzpunkts (ÄP), ebenfalls ein Wendepunkt – allerdings mit größerer Tangentensteigung.
Beim Auffinden der pKa-Werte gibt es Schwierigkeiten: Der erste pKa-Wert (1,46) liegt so niedrig, dass er mit dem Säure/Base-System der Hydronium-Ionen überlappt. Damit ist der Wendepunkt des Oxalsäuresystems verdeckt. Der zweite pKa-Wert bei pH 4,40 ist dagegen leicht als Wendepunkt auszumachen.
Wie findet man dann den ersten pKa-Wert? Man erinnere sich an die Definition eines pKa-Werts. Das ist derjenige pH-Wert, bei dem ein Säure/Base-System zu 50 % als Anion vorliegt. Deshalb liest man einfach den pH-Wert ab, bei dem die Äquivalenz an NaOH-Zugabe 0,5 (abzulesen auf der Abszisse) beträgt. Der zweite pH-Wert liegt bei 1,5 Äquivalenz.
Hier sind die pH-Werte der entsprechenden Titrationspunkte:
(Konzentration der vorgelegten Oxalsäure: c = 0,1 mol/l)
| Start | 1,23 |
| pKa1 | 1,46 |
| ÄP1 | 2,95 |
| pKa2 | 4,40 |
| ÄP2 | 8,70 |
Weitere Texte zum Thema "Oxalsäure"