Phenol - eine schwache Säure
Experimente:
Versuch: Nachweis der Säureeigenschaft von Phenol mit Phenolphthaleinlösung
Versuch: Nachweis der Säureeigenschaft von Phenol mit Lackmuslösung
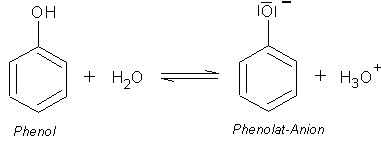
Phenol reagiert als Säure
Eine wässrige Lösung von Phenol reagiert deutlich sauer (-> Versuch),
es sind also Hydronium-Ionen vorhanden. Dabei ist Phenol nur eine schwache Säure - etwa so stark wie die
Blausäure. Ihr pKs-Wert beträgt 9,89. Das heißt, dass bei diesem pH-Wert die Hälfte des
Phenols als Anion (Phenolat) vorliegt.
Reaktion des Phenols als Säure:

Die leichtere Abspaltung von Protonen beim Phenol im Vergleich zu den Alkoholen ist auf die Mesomerie des Phenolmoleküls zurückzuführen. Durch die Einbeziehung der OH-Gruppe in die Mesomerie verringert sich die Elektronendichte um den Sauerstoff. Man kann für das Phenol sogar mesomere Grenzformen beschreiben, bei denen der formal dreibindige Sauerstoff eine positive Ladung trägt. Die OH-Bindungslänge im Phenol ist folglich größer als die in einem Alkohol.
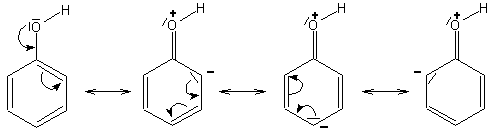
Die Abspaltung von H+ wird außerdem durch einen anderen Effekt begünstigt: Denn auch das Phenolat-Ion wird mesomeriestabilisiert. Seine negative Ladung wird über das ganze Molekül verteilt, wobei sein realer Zustand zwischen den folgenden Grenzformeln des Phenolat-Ions liegt:
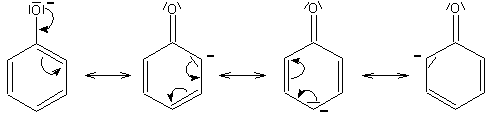
Der mesomere Zustand des Phenolat-Anions weist eine geringere Energie auf als der des undissoziierten Phenols. Man kann es auch so erklären: Die Trennung von Plus- und Minus-Ladungen erfordert mehr Energie als das Herumschieben einer negativen Ladung. Das zeigt sich auch im Absorptionsverhalten der beiden Spezies: Die UV-Absorption des Phenolats ist gegenüber der von Phenol deutlich ins Längerwellige verschoben.
Weitere Texte zum Thema „Phenole“