 |
| (Foto: Daggi)
Hierzu gibt es einen Film (9,4 MB) Klicke hier |
Reaktionen von Phenolphthalein-haltigen Lösungen mit Alkali- und Erdalkalimetallen
Experimente:
Versuch: Reaktion von Phenolphthalein-haltigen wässrigen Lösungen mit Alkali- und Erdalkalimetallen
Gern wird Phenolphthalein auch bei der Reaktion von Wasser mit metallischem Natrium
oder auch mit Calcium eingesetzt (-> Versuch).
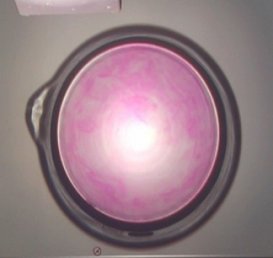
Besonders schön ist der Versuch, wenn man eine große Kristallisierschale mit wässriger Phenolphthalein-Lösung auf die Projektionsfläche eines Overheadprojektors stellt. Wirft man ein frisch geschnittenes Stückchen Natriummetall in die Lösung, so flitzt das auf dem Wasser herum und hinterlässt eine purpurfarbene Spur.
 |
| (Foto: Daggi)
Hierzu gibt es einen Film (9,4 MB) Klicke hier |
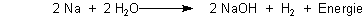
Bei dieser Reaktion entsteht in großen Mengen gasförmiger Wasserstoff. Der treibt das Metallstückchen, das im Falle des Natriums wegen der freiwerdenden Reaktionswärme sogar zu einem runden Kügelchen schmilzt, wie ein Motorboot herum. Vorsicht! Die freiwerdende Energie kann dazu führen, dass sich alles entzündet. Man kann aber statt Natrium Lithium oder Calcium nehmen. Die sind „gutmütiger“.
Allerdings gibt es jedoch im analogen (aber gefährlichen!) Reagenzglasversuch Probleme, weil das Phenolphthalein nur kurz purpurfarben „aufleuchtet“, um sich dann wieder rasch zu entfärben.
Die Gründe hierfür sind nicht nur das übermäßig alkalische Milieu und die entfärbende Carbinolbildung des Phenolphthaleins, sondern auch die Tatsache, dass Phenolphthalein durch den bei der Reaktion der Metalle mit Wasser entstehenden atomaren Wasserstoff „in statu nascendi“ (Symbol [H•]) zu einer farblosen Verbindung reduziert wird.
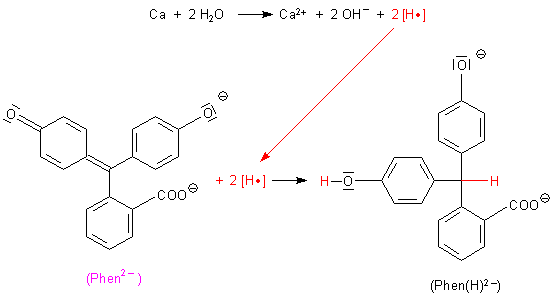
Reduktion von Phenolphthalein
Hinweis: Das Bild ist nur formal zu verstehen: In alkalischem Milieu entsteht natürlich das farblose Tri-Anion Phen(H)3-, d. h., dass beide phenolische Gruppen dissoziiert vorliegen.
Zu den genaueren chemischen Hintergründen der Reduktion lesen Sie bitte auch die Antwort auf die Frage Nr. 1576.
Weitere Texte zum Phenolphthalein