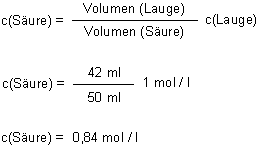
Die Auswertung der volumetrischen Titration von Haushaltsessig
Experimente:
Versuch: Titration von Haushaltsessig
Der Gehalt an Essigsäure ist genau vorgeschrieben
Er liegt zwischen 50 und 150 g Essigsäure / Liter Lösung. Das können wir leicht
nachprüfen, indem wir Haushaltsessig titrieren (-> Versuch).
Zum Beispiel haben wir 50 ml Essig vorgelegt. Bei der Titration benötigen wir 42 ml Natronlauge (c = 1 mol/l), bis der Indikator Phenolphthalein umschlägt. Die Auswertung erfolgt mit der folgenden Formel:
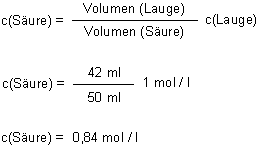
Die Angaben auf der Flasche sind im allgemeinen Masseprozent. Um die zu ermitteln, müssen wir noch die Molmasse von Essigsäure berücksichtigen. Sie beträgt (wie wir leicht ausrechnen können) 60 g / mol.
m(Säure) = 0,84 mol / l · 60 g / mol
m(Säure) = 50,4 g / l
Ein Liter des von uns ausgewählten Haushaltsessigs enthält also etwa 50 g Essigsäure. Bezogen auf 1000 ml sind das 5 %. (Dabei tun wir so, als wenn ein Liter Essig 1000 g wiegt. Außerdem berücksichtigen wir nicht, dass bei der Lösung von Essigsäure in Wasser noch bestimmte Volumenveränderungen auftreten können.)
Weitere Texte zum Phenolphthalein