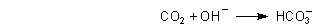
Beachtenswerte Besonderheiten von Titrationen mit Phenolphthalein
Experimente:
Klicke hier
In einer anderen Webseite haben wir bereits beschrieben, für welche Titrationen Phenolphthalein
geeignet ist. Klicke hier. Hier geht es um einige weitere praktische
Tipps.
Zunächst etwas zur Herstellung der Phenolphthalein-Lösung
Als Lösemittel wird eine 50 %ige wässrige Ethanollösung angegeben. Besser ist es, den Indikator
erst in reinem (oder 96 %igem) Ethanol vorzulösen. Anschließend füllt man mit Wasser auf das doppelte
Volumen auf. (Dieses Verfahren ist grundsätzlich anzuwenden, wenn man einen Farbstoff in Wasser lösen will
- zum Beispiel für eine kinetische Analyse.)
Hinweise zur Titration
Anfänger neigen dazu, zum Schluss der Titration Natronlauge immer langsamer zuzugeben, um
ja nicht den Äquivalenzpunkt zu verpassen. Das ist in diesem Fall ausgesprochen falsch. Denn
die Lösung scheint sich immer wieder zu entfärben!
Die Ursache ist, dass die pinkrote Lösung alkalisch ist und deshalb begierig CO2 aus der Luft absorbiert. Das wird durch das angesagte gute Rühren während der Titration noch gefördert. Dieses CO2 bildet Kohlensäure bzw. Hydrogencarbonat und verbraucht deshalb entsprechende Mengen an Natronlauge.
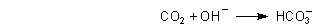
Die Folge: Der Indikator zeigt immer wieder an, dass „seiner Meinung nach“ noch nicht genügend Lauge zugegeben worden ist.
Auf diese Weise geben unerfahrene und deshalb vorsichtig agierende Leute wesentlich mehr Lauge zu als nötig. Letztlich könnten sie so bis zum nächsten Morgen weitermachen…
Spezialisten führen aus diesem Grund vor der eigentlichen Messung zur Orientierung über die ungefähre Lage des Äquivalenzpunkts mit einem Teil der zu untersuchenden Lösung eine grobe Vortitration durch. Sie wissen: Zum Schluss muss man schnell titrieren und dabei gut rühren. Als Endpunkt notiert man denjenigen Volumen-Wert, bei dem die Rötung die gesamte Lösung umfasst und zugleich einige Sekunden stabil bleibt.

Helene zeigt den richtigen Umschlagspunkt der Titration mit Phenolphthalein
(Foto: Daggi)
Beachten muss man auch, dass man keinen zu großen Überschuss an Lauge zugeben darf. Denn ab pH 12-13
beginnt Phenolphthalein, sich wieder zu entfärben. Diese chemische Reaktion erklären
wir hier.
Weitere Texte zum Phenolphthalein