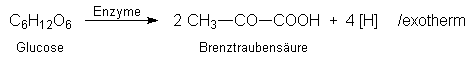
Für Experten:
Ein Exkurs in die Biochemie: Wie Bakterien anaerob leben
und dabei Eisensulfid produzieren
In vielen Sedimenten findet man Pyrit und Markasit. Beide haben die chemische Formel FeS2. Ihre Ionen sind Fe2+ und S22-. Wo kommen die her?
Dabei helfen bestimmte Bakterien. Sie wandeln Eisen(III)-Ionen zu Eisen(II)-Ionen und Sulfat-Ionen zu Sulfid-Ionen um. Es handelt sich dabei um Reduktionen.
Reduktionsmittel ist letztlich Wasserstoff, der aus der als Nahrung dienenden
abgestorbenen Biomasse stammt.
Beispielsweise bilden Bakterien zur Energieumwandlung aus Traubenzucker (Glucose)
Brenztraubensäure (bzw. deren Salz Pyruvat):
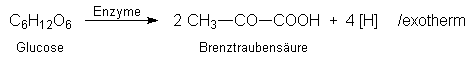
Mit dem Symbol [H] bezeichnen wir übertragbaren Wasserstoff, der an ein Oxidationsmittel wie NAD gebunden ist. Nach kurzer Zeit ist das Oxidationsmittel NAD aufgebraucht, der Stoffwechsel kommt zum Erliegen. Damit die lebensnotwendige Energieumwandlung für die Bakterien weitergehen kann, muss das Oxidationsmittel wieder freigesetzt, also oxidiert werden. Bei Luftzutritt macht dies der Sauerstoff. Unter anaeroben Bedingungen dagegen übertragen die Bakterien den Wasserstoff enzymatisch auf andere Stoffe. Bekannt ist sicherlich der Acetaldehyd, der dabei zum Ethanol reduziert wird:
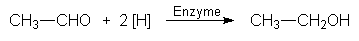
Aus der Brenztraubensäure wird so Milchsäure. Diesen Stoffwechseltyp nennen wir Gärung.
Im Fall der Pyritbildung sind die Sulfat-Ionen die Oxidationsmittel:
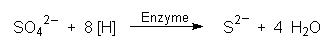
Die Reduktion kann sogar noch weitergehen, so dass auch S22--Ionen entstehen. Auch die Bildung von Schwefel ist möglich.
Aber auch Eisen(III)-Ionen können reduziert werden:

Die Bakterien atmen also nicht Sauerstoff, sondern vergären Sulfat- bzw. Eisen(III)-Ionen.
Auf diese Weise sind die Ionen entstanden, die sich zunächst zu Markasit zusammenfügen. Das lagert sich in den nächsten Millionen von Jahren zu Pyrit um.
 |
| Ammonit Schlotheimia im Schwarzjura-Ton
(Foto: Daggi) |
Weitere Texte zum Thema „Pyrit und Feuerstein“