Aceton - eines der bevorzugten Lösemittel
Experimente:
Versuch: Lösen und Wiederaufschäumen von Polystyrol
Allgemeines über Lösemittel
Lösemittel sind in allen flüssigen Wasch- oder Reinigungsmitteln enthalten. Das wichtigste
und gleichzeitig umweltfreundlichste Lösemittel ist immer noch Wasser. Da Wasser sehr preiswert
ist, setzen die Reinigungsmittelhersteller es ihren Produkten gerne reichlich zu. Teilweise sind
bis zu 94 % Wasser in Reinigern enthalten. Dies hat den Vorteil einer leichteren Dosierbarkeit
und verringert gleichzeitig das Unfallrisiko, da verdünnte Chemikalienmischungen natürlich
nicht so gefährlich sind wie konzentrierte.
Nicht jedes Lösemittel ist für jede Verschmutzung geeignet. Es gilt hierbei der alte Spruch:
Gleiches löst Gleiches.
Viele Anschmutzungen wie Fette oder Öle sind im polaren Wasser schlecht, in unpolaren organischen
Lösemitteln dagegen gut löslich. So können Fettflecken durch eine Behandlung mit Aceton entfernt werden.
Aceton als Lösemittel
Aceton gehört zu den am häufigsten verwendeten Lösemitteln der Industrie. Es wird vor allem auch als
Extraktions- oder auch Quellungsmittel verwendet. Es verdunstet sehr schnell, wodurch es auch in der
Kleber- oder Lackindustrie eingesetzt wird. Aber auch im täglichen Gebrauch konnten wir es bisher finden,
beispielsweise im Nagellackentferner.
Besonders interessant ist auch die Tatsache, dass es in Acetylenflaschen zu finden ist. Hier löst es das Acetylen, wodurch es möglich ist, eine größere Menge Acetylen in ein definiertes Volumen einzubringen als es durch Kompression möglich gewesen wäre.
Zusammenfassend können wir feststellen: Aceton ist mit Wasser, Alkohol, Ether, Benzol und Chloroform beliebig mischbar. Es löst neben dem Gas Acetylen auch Öle, Fette, Harze und vieles mehr.
Aceton ist sowohl mit Wasser als auch mit Ethanol in jedem Verhältnis mischbar. Es gehört zu der Gruppe der aprotischen Lösemittel, das heißt, dass es keine Protonen freisetzen kann. Gleichzeitig besitzt es eine polare Doppelbindung zwischen dem Kohlenstoffatom und dem Sauerstoff-Atom. Aceton kann sowohl unpolare und einige nicht zu polare Stoffe lösen. Im Vergleich mit Wasser ist seine Polarität zwar geringer, allerdings ermöglicht ihm seine Struktur auch die Lösung von Fetten. Vergleichen wir mal die Struktur von Aceton mit der des Wassers.
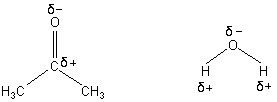
Struktur des Aceton- und des Wassermoleküls
Das Acetonmolekül besitzt ebenso wie das Wassermolekül eine negative Polarisierung am Sauerstoffatom. Die Polarisierung ist jedoch beim Aceton wesentlich geringer, da die Methylgruppen einen "elektronenschiebenden" Einfluss (+I-Effekt) ausüben.
Das oben genannte Prinzip "Gleiches löst Gleiches" bedeutet also im Fall des Acetons, dass seine Moleküle sowohl über unpolare als auch polare Anteile verfügen und dadurch unpolare und polare Stoffe (letztere zumindest in Grenzen...) zu lösen vermögen.
Weitere Texte zum Thema „Aldehyde und Ketone“