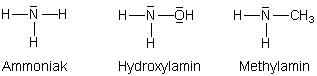
Addition von Aminen an Carbonylverbindungen
Experimente:
Versuch: Formaldehyd addiert Ammoniak
Versuch: Synthese von Urotropin
Reaktionen von Carbonylgruppen mit Stickstoffbasen
Eine Stickstoffverbindung mit einem freien Elektronenpaar ist eine Base, eine Stickstoffbase.
Davon gibt es im Wesentlichen drei:
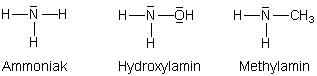
Beispiele für Stickstoffbasen
(Eine weitere Stickstoffbase ist das Hydrazin; das wird uns bei der Kohlenhydratchemie begegnen.)
Diese Verbindungen reagieren alle nach demselben Muster mit Aldehyden oder auch Ketonen. Es handelt sich in jedem Fall um eine nucleophile Additionsreaktion am C-Atom der Carbonylgruppe.
An Hand der Reaktion von Ammoniak und Aceton soll der zugrunde liegende Mechanismus aufgezeigt werden.
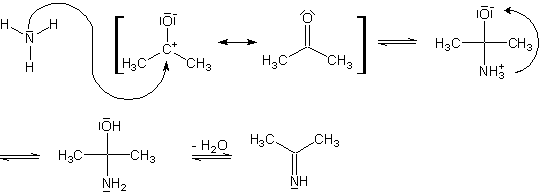
Reaktionsmechanismus der Addition von Stickstoffbasen an Carbonylverbindungen
Ammoniak bindet mit dem freien Elektronenpaar an das positiv polarisierte C-Atom der Carbonylgruppe. Ein Proton wandert im Molekül von dem positiv geladenen Stickstoffatom zu dem negativ geladenen Sauerstoffatom. Es kommt zu einem Ausgleich der Ladungen. Im letzten Schritt wird Wasser abgespalten, wodurch eine Doppelbindung zwischen dem Kohlenstoff- und dem Stickstoffatom entsteht.
Diese Reaktionen verlaufen analog mit den anderen Stickstoffbasen.
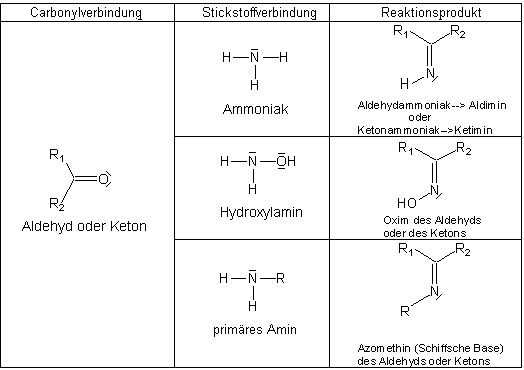
Übersicht über die Reaktionen von Stickstoffbasen mit einem Aldehyd oder Keton
Im Labor wird die Addition auch zum Nachweis von Carbonylverbindungen verwendet. Denn die Addukte sind feste Substanzen, die sich anhand ihrer Schmelzpunkte identifizieren lassen. Das betrifft vor allem die Oxime. In der Zuckerchemie sind die Osazone, die sich durch zweifache Addition von Hydrazinderivaten an Kohlenhydrate bilden, für die Aufklärung der Strukturen wichtig gewesen.
Weiter sind solche Verbindungen auch als Synthese-Schutzgruppen für Aldehydfunktionen oder umgekehrt für Aminogruppen wichtig.
Besonders wichtig: Die Schiffschen Basen
Wenn ein primäres Amin an eine Carbonylverbindung bindet, bildet sich ein instabiles Zwischenprodukt,
das Wasser eliminiert. Es entsteht eine ungesättigte Verbindung, ein Azomethin. Dieses
nennt man auch Schiffsche Base.
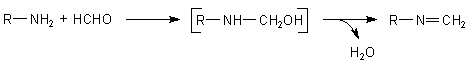
Diese Reaktionen besitzen in der Biochemie einen zentralen Stellenwert. Beispielsweise bedient sich das Vitamin B6 dieser Reaktion. Das Vitamin besitzt eine Aldehydgruppe, an die es die Aminoenden der Aminosäuren bindet und mit ihnen Schiffsche Base bildet (klicke hier).
Neben ihrer Bedeutung für den Stoffwechsel der Aminosäuren waren die Schiffschen Basen auch für die
Strukturaufklärung vieler biochemischer Verbindungen wichtig. So konnte man durch Titration mit
Formaldehydlösungen die freien Aminogruppen z. B. in einem Protein "zählen".
Wichtig war auch die "Formoltitration" von Aminosäuren, wobei man durch die Maskierung der Aminogruppe
als Schiffsche Base einen pKs-Wert unterdrücken konnte. So gelang es, über das Dissoziationsverhalten
der Gruppen in einer Aminosäure auf deren Struktur zu schließen. Man muss bedenken, dass es früher
solche formidablen Geräte wie das NMR nicht gab!
Was ist mit dem N-Formyl-Methionin?
N-Formyl-Methionin gilt in der Genetik als Interpunktionszeichen, mit dem bei der Proteinbiosynthese
eine neue Peptidkette beginnt. Wieso ist das überhaupt stabil? Es sollte doch spontan ein Azomethin bilden.
Der Trick ist, dass hier nicht ein freies Formaldehydmolekül direkt angreift, sondern in gebundener Form als N-Formyl-Tetrahydrofolsäure. Es handelt sich also nur um einen enzymatischen Gruppentransfer:
Met-NH2 + THF-CHO ———> Met-NH-CHO + THF-H
Dieses Met-NH-CHO kann kein Wassermolekül abspalten.
Weitere Texte zum Thema „Aldehyde und Ketone“