Die qualitative Elementaranalyse von Ethanol
Experimente:
Versuch: Qualitative Elementaranalyse der Alkohole
Versuch: Hinweis auf Sauerstoff im Ethanolmolekül
Bei der qualitativen Elementaranalyse (-> Versuch) bestimmt
man, welche Elemente am Aufbau eines Moleküls beteiligt sind.
Um die Zusammensetzung von Ethanol herauszufinden, muss man die Substanz in einer Abdampfschale verbrennen. Die Verbrennungsgase werden durch ein U-Rohr und eine Gaswaschflasche geleitet. Von alleine tun sie das natürlich nicht. Dazu ist eine Wasserstrahlpumpe nötig, die die Verbrennungsgase durch die Apparatur zieht.
In dem U-Rohr befinden sich Calciumoxid CaO und Phenolphthalein. Nach und nach kondensiert
eine Flüssigkeit, was durch die äußere Kühlung mittels Wasser im Becherglas noch beschleunigt
wird und es entstehen rosa Pünktchen in dem weißen Pulver. Wie ist das zu erklären?
Die Flüssigkeit ist Wasserdampf. Und wenn man Calciumoxid in Wasser auflöst, dann geschieht
folgende Reaktion:
CaO + H2O ———> Ca(OH)2
Es ist Calciumhydroxid Ca(OH)2 entstanden und dies ist, wie der Name schon sagt,
ein Hydroxid, also eine Base. Wird es in Wasser gelöst, bilden sich OH--Ionen,
die die Lösung alkalisch machen. Dass es sich hierbei wirklich um eine Base handelt, zeigt
Phenolphthalein, ein oft verwendeter Indikator. Die
Hydroxid-Ionen sorgen dafür, dass das Phenolphthalein pink gefärbt wird (das sind hier die
Pünktchen). Damit die Reaktion stattfindet, muss hier also Wasser entstanden sein - das
Oxidationsprodukt von Wasserstoff.
Statt CaO verwendet man zum Wassernachweis auch gern blaues Cobaltchlorid-Papier. Das
färbt sich mit Wasser rosa. Der Nachweis von Wasser mit farblosem Kupfer(II)-sulfat ist
dagegen sehr unempfindlich und hier nicht zu empfehlen.
Auch Kohlenstoff wird bei der Verbrennung oxidiert, wobei Kohlenstoffdioxid entsteht. Eine typische Nachweisreaktion dafür findet in der Gaswaschflasche statt, die mit Kalkwasser gefüllt ist. Allmählich trübt sich aufgrund der Bildung von Calciumcarbonat die vorher klare Flüssigkeit.
Ca(OH)2 + CO2 ———> CaCO3 + H2O
Am Aufbau des Ethanolmoleküls müssen zum einen Wasserstoffatome beteiligt sein und zum anderen Kohlenstoffatome.
Somit entstehen genau die gleichen Verbrennungsprodukte wie bei den Alkanen.
Ist Alkohol also ein Alkan?
Die Antwort lautet: Nein! Denn die qualitative Elementaranalyse ist noch nicht abgeschlossen.
Es muss noch überprüft werden, ob sich weitere Atomsorten nachweisen lassen. Und tatsächlich
ist als weiteres Element Sauerstoff enthalten. Das kann man aber mit dem oben angeführten
Versuch nicht nachweisen.
Man kann Ethanoldämpfe in luftfreiem Gefäß mit heißem Magnesium reagieren lassen. Diese Reaktion entspricht in gewisser Weise der allgemein bekannten zwischen Wasserdampf und Magnesium.
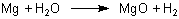
Neben MgO bilden sich auch Mg(OH)2 sowie gemischtes Magnesiumoxidhydroxid. Beim Ethanol entstehen neben Ethan Produkte wie Ethen, Ethin, Ruß und Wasserstoff.
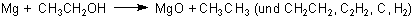
Dieser Nachweis ist recht unspezifisch; man spricht stattdessen lieber von einem Hinweis auf das Vorliegen von Sauerstoff.
Bleibt noch die Frage: Welche Formel hat das Ethanolmolekül?
Dazu müssen wir eine quantitative Elementaranalyse durchführen.
Die liefert uns das Massenverhältnis der Elemente in einer Verbindung.
Weitere Texte zum Thema „Alkohol“