
Wie man die Struktur von Ethanol ermittelt
Experimente:
Versuch: Ist Alkohol eine Lauge? Oder eine Säure?
Die quantitative Elementaranalyse liefert das
Verhältnis der Massen der Elemente bzw. die relative Anzahl der Atome in einer Verbindung.
Untersuchungen von Ethanol ergeben das Atomzahlverhältnis
C:H:O = 2:6:1, so dass man auf die Summenformel C2H6O kommt.
Diese Molekülformel sagt allerdings gar nichts darüber aus, wie die Moleküle miteinander verknüpft sind. Siehe hierzu diese Webseite.
Um die Stellung der Atome im Molekül zueinander herauszubekommen, sind besondere Untersuchungsmethoden nötig. Dafür muss man sich überlegen, ob es charakteristische Reaktionen für bestimmte Strukturen gibt oder ob man Vergleiche zu bereits bekannten Stoffstrukturen anstellen kann.
Für die Summenformel C2H6O gibt es zwei mögliche Strukturen:

In Struktur I sind alle Wasserstoffatome an Kohlenstoffe gebunden. In Struktur II hat ein Wasserstoffatom eine Sonderstellung, da es sich an einem Sauerstoffatom befindet.
Nun bleibt die Frage, wie sich herausfinden lässt, welches die Struktur von Ethanol ist. Dazu muss man das Reaktionsverhalten der Atomgruppierungen kennen. In Formel II liegt eine polare OH-Gruppe vor, von der man erwarten kann, dass sie ähnlich wie Wasser reagiert.
Eine typische Reaktion von Wasser ist die mit Natrium, bei der sich Wasserstoff entwickelt und entzündet. Lässt man Ethanol mit Natrium reagieren, so stellt man Gemeinsamkeiten fest.
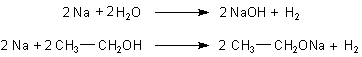
Bei beiden entsteht Wasserstoff und beide reagieren zu einer Art von Lauge (Natriumhydroxid bzw. Natriumethanolat). Der einzige Unterschied ist der weniger heftige Verlauf bei der Reaktion von Ethanol mit Natrium.
Natrium kann nur Wasserstoffatome aus OH-Gruppen ersetzen und nicht aus Kohlenwasserstoffen. Das zeigt auch die Tatsache, dass Natrium wegen seiner hohen Reaktivität ständig unter Petroleum aufbewahrt werden muss, und das besteht ausschließlich aus Kohlenwasserstoffen. Offensichtlich kann Natrium nicht mit Wasserstoffatomen reagieren, die direkt an einem C-Atom gebunden sind.
Somit muss Ethanol, genau wie Wasser, eine polare OH-Gruppe besitzen. Deshalb ist die richtige Struktur die der Strukturformel II. Wir schreiben diese kurz so:
CH3-CH2OH
Um die Sonderstellung der OH-Gruppe im Alkoholmolekül deutlich zu machen, schreibt man anstatt C2H6O vorzugsweise die Summenformel C2H5OH. Chemiker bezeichnen die OH-Gruppe auch als Hydroxyl- oder Hydroxygruppe. Allerdings sprechen sie meistens einfach nur von der "OH-Gruppe".
Die Verbindung mit der Strukturformel I heißt übrigens "Dimethylether".
Last but not least
Um sich die Halbstruktur-Formel von Ethanol zu merken, bedient man sich gern diesen Spruchs:
Herr Ober, fünf Helle, zwei Cognac!
Das folgende Bild zeigt das Ethanolmolekül in voller Schönheit als Kalottenmodell.
Bild 1: Kalottenmodelle von Ethanol
(Foto: Blume)
Genau genommen hat das Molekül mitnichten die linke, optisch ansprechende Form eines Hündchens, das auf vier Beinen steht. Es nimmt im Grundzustand eher die rechte, verdrehte und deshalb energieärmere „Auf Lücke“-Stellung eines pinkelnden Hunds ein. Diese Stellung hat ja auch etwas mit Alkoholgenuss zu tun, wie uns das Oktoberfest mit seinen Randerscheinungen lehrt…
Weitere Texte zum Thema „Alkohol“