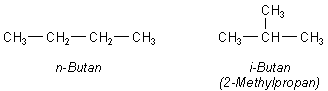
Die Isomeren des Butanols
Vom Butanol gibt es vier Isomere. Um deren Strukturformeln zu zeichnen, muss man berücksichtigen, dass der den Alkoholen zugrundeliegende Kohlenwasserstoff Butan bereits selbst zwei Isomere bildet: das n-Butan und das verzweigte Isobutan (2-Methylpropan).
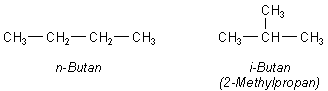
Vom n-Butan leiten sich folgende Alkohole ab:
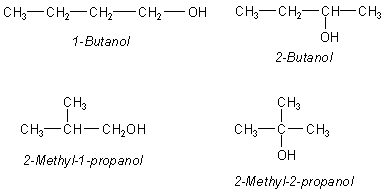
2-Methylpropan ist der Kohlenwasserstoff für folgende Alkohole:
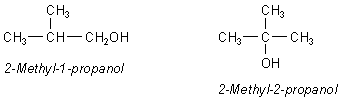
Befindet sich die OH-Gruppe an einem endständigen C-Atom, spricht man von einem primären Alkohol. Sind mit dem betreffenden C-Atom zwei weitere C-Atome verbunden, handelt es sich um einen sekundären Alkohol. Trägt das C-Atom drei weitere C-Atome, so erhalten wir tertiäre Alkohole. Butan bildet also zwei primäre, einen sekundären und einen tertiären Alkohol.
Die vier Butanole haben unterschiedliche physikalische Eigenschaften, z. B. verschiedene Schmelz- und Siedepunkte sowie Dichten. Zum Vergleich haben wir auch die isomeren Propanole in die Tabelle mit aufgenommen.
| Schmelzpunkt °C | Siedepunkt °C | Dichte (g/ml) | |
| 1-Butanol | -88,9 | 117,7 | 0,810 |
| 2-Butanol | -114,7 | 99,5 | 0,808 |
| 2-Methyl-1-propanol | -108 | 107,9 | 0,802 |
| 2-Methyl-2-propanol | 25,5 | 82,5 | 0,789 |
| 1-Propanol | -126,5 | 97,4 | 0,8035 |
| 2-Propanol | -89,5 | 82,4 | 0,7855 |
Die Isomeren haben auch verschiedene chemische Eigenschaften, zum Beispiel hinsichtlich der Substitution.
Zu beachten ist weiterhin, dass es vom 2-Butanol noch ein Spiegelbild-Isomeres gibt (Entantiomerie). Der Grund ist, dass sich am C-Atom 2 vier verschiedene Substituenten befinden.
1-Butanol - im Labor unverzichtbar
Der Tabelle entnimmt man, dass 1-Butanol einen tiefen Schmelzpunkt und einen hohen Siedepunkt hat.
Sein Dampfdruck ist bei Zimmertemperatur sehr niedrig. Das heißt praktisch, dass man mit dieser Substanz
auch in offenen Gefäßen gefahrlos arbeiten kann.
Folge: Das 1-Butanol erfreut sich im Labor eines gewissen Rufs als Flüssigkeit für Kältebäder. Diese
benötigt man zum Beispiel zum Betrieb von Kühlfallen bei der Vakuumdestillation oder Gefriertrocknung.
Weitere Texte zum Thema „Alkohol“