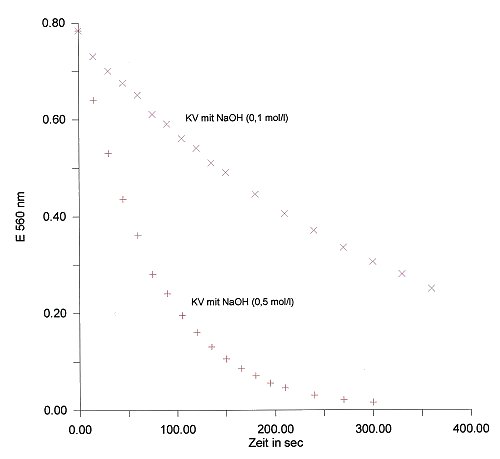
Ergebnisse der kinetischen Analyse der Entfärbung von Kristallviolett
Ergebnis der quantitativen Analyse der Reaktion
KV + OH- ———> [KV-OH]-
| NaOH
c = 0,1 mol/l |
NaOH
c = 0,5 mol/l |
||||
| Zeit in sec | E (560 nm) |
ln E | Zeit in sec | E (560 nm) |
ln E |
| 0 15 30 45 60 75 90 105 120 135 150 180 210 240 270 300 330 360 |
0.783 0.73 0.7 0.675 0.65 0.61 0.59 0.56 0.54 0.51 0.49 0.445 0.405 0.37 0.335 0.305 0.28 0.25 |
-0.24462261 -0.3147107 -0.356675 -0.3930426 -0.4307829 -0.4942963 -0.5276328 -0.5798185 -0.6161861 -0.6733446 -0.7133499 -0.809681 -0.9038682 -0.9942523 -1.093625 -1.187443 -1.272966 -1.386294 |
0 15 30 45 60 75 90 105 120 135 150 165 180 195 210 240 270 300 |
0.783 0.64 0.53 0.435 0.36 0.28 0.24 0.195 0.16 0.13 0.105 0.085 0.07 0.055 0.045 0.03 0.02 0.015 |
-0.24462261 -0.4462871 -0.6348783 -0.8324093 -1.021651 -1.272966 -1.427116 -1.634756 -1.832582 -2.040221 -2.253795 -2.465104 -2.65926 -2.900422 -3.101093 -3.506558 -3.912023 -4.199705 |

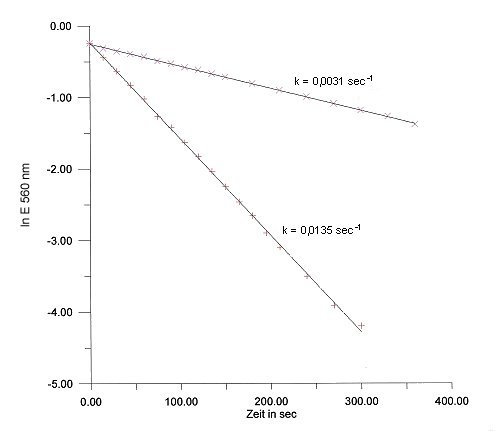
Die Geschwindigkeitskonstanten k sollten sich verhalten wie 1:5. Grund für die Abweichung ist die nicht genau einstellbare NaOH-Konzentration. Deshalb arbeitet man besser mit basischen Pufferlösungen.
Weitere Texte zum Thema „Reaktionskinetik“