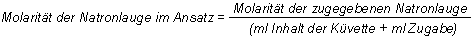
Versuch: Reaktionskinetik der Entfärbung von Kristallviolett
Schülerversuch; 30 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Geräte
Messkolben, verschließbare Küvette, Messpipette (1 ml) oder besser eine Eppendorf-Pipette
(100 µl), Fotometer.
Chemikalien
Kristallviolett, Natronlauge verschiedener Konzentrationen (c = 0,01 mol/l; 0,1; 0,2 usw.) (Xi),
destilliertes Wasser.
Hinweis für Schulen
Mittlerweile darf Kristallviolett nicht mehr in der Schule verwendet werden, da es cancerogene Verbindungen
wie Diphenylamin-Derivate freisetzen kann. Unsere Empfehlung: Nehmen Sie bei dem Versuch stattdessen Phenolphthalein,
das in alkalischem Milieu rot gefärbt ist. Das Absorptionsmaximum liegt bei 553 nm. Den folgenden Text müssen Sie
sich entsprechend geändert vorstellen…
Durchführung
Achtung: Küvette nicht im optischen Teil berühren, sonst gut reinigen.
Man gleicht das Fotometer bei 560 nm gegen eine Küvette mit Wasser ab.
Man stellt sich eine Stammlösung von Kristallviolett her, deren Konzentration so bemessen ist, dass die Extinktion E bei 560 nm etwa 0,8 beträgt ([KV] ca. 1,5 · 10-5 mol/l).
Dann gibt man in die Küvette mit einer Pipette 0,1 ml Natronlauge (c = 0,1 mol/l) zu, dann die
für die Küvette notwendige Menge an Kristallviolettlösung. Man startet zugleich die Stoppuhr.
Nach kurzem, gutem Vermischen stellt man die verschließbare Küvette in das Fotometer
und liest in regelmäßigen Zeitabständen (zuerst 15 sec, dann nach Bedarf länger) die
Extinktion E ab.
Nach der Messung ermittelt man mit einem pH-Meter den pH-Wert der Lösung.
Der Versuch wird mit Natronlauge anderer Konzentrationen wiederholt.
Auswertung
(Siehe dazu Quellwebseite).
Man trägt für jede Messung die Messwerte in ein Diagramm Extinktion gegen Zeit auf.
Zur Ermittlung der Geschwindigkeitskonstanten pseudo-1. Ordnung k' trägt man ln E
gegen die Zeit auf.
Aus der Steigung des linearen Bereichs berechnet man k'.
k' = [ ln E(t1) - ln E(t2) ] / (t1 - t2)
Man berechnet für jeden Ansatz die Konzentration der Lauge und vernachlässigt dabei den Anteil der OH--Ionen, die mit dem Kristallviolett reagiert haben.
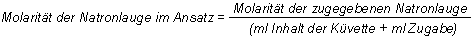
Man trägt anschließend in einem Diagramm k' gegen die Konzentration der Lauge auf. Die Steigung muss gleich 1 sein. Dann liest man bei [OH-] = 1 den Wert von k ab.