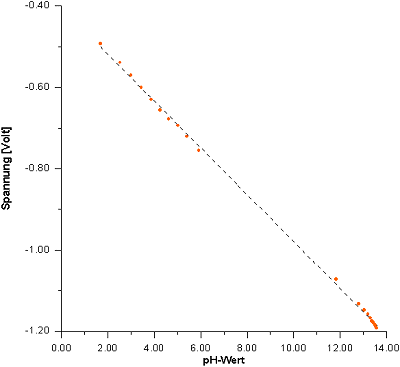
Kennlinie der Antimonelektrode. Erhalten durch Titration der Citronensäure (50 ml, c = 0,33 mol/l);
simultane Messung von Spannung (Antimon gegen Mercurisulfat) und pH-Wert (Glaselektrode)
Quantitativ betrachtet: Die pH-Abhängigkeit des Potentials einer
Antimonelektrode
(Zu dieser Webseite vergleiche die Basiswebseite.)
Mit Hilfe der Titrationskurven und bekannter pH-Werte kannst du eine quantitative Beziehung
zwischen der Spannung der Antimonelektrode und dem pH-Wert der Lösung herleiten.
Dazu suchst du die Wendepunkte auf, die den bekannten Werten wie dem Neutralpunkt, pK-Werten
der titrierten Säuren oder Äquivalenzpunkten entsprechen. Du kannst aber auch
während einer Titration simultan Spannung und pH-Wert ermitteln, indem du einmal
zusätzlich ein pH-Meter benutzt. Du erhältst z. B. im Fall der Titration von
Citronensäure eine Gerade (-> folgendes Bild).

Kennlinie der Antimonelektrode. Erhalten durch Titration der Citronensäure
(50 ml, c = 0,33 mol/l);
simultane Messung von
Spannung (Antimon gegen Mercurisulfat) und pH-Wert (Glaselektrode)
Die Gleichung der Geraden lautet (wie du leicht nachprüfen kannst; frage deinen Mathe-Lehrer!):
E = - 0,4 - 0,059 pH
Der Ordinatenabschnitt -0,4 Volt ist näherungsweise das Standardpotential der Antimonelektrode (E0 = -0,443 Volt, bezogen auf Mercurisulfat). Die Steigung ist die einer Wasserstoffelektrode.
Damit wird deutlich, dass es eine lineare Beziehung zwischen pH-Wert und Spannung gibt; die Antimonelektrode kann also wie die Wasserstoffelektrode als Säure/Base-Titrationssystem und sogar zur pH-Messung für einzelne pH-Werte eingesetzt werden.
Die empirisch gefundene Geradengleichung kannst du auch theoretisch herleiten:
Die Nernstsche Gleichung für Antimon ist:
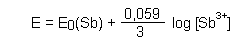
Das Löslichkeitsprodukt von Antimonhydroxid ist:
L = [Sb3+] · [OH¯]3
Damit können wir [Sb3+] durch [OH¯] ersetzen:
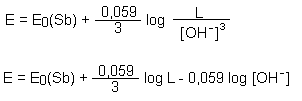
Wir führen den pOH-Wert ein:
pOH = - log [OH¯]
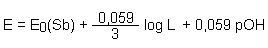
Mit der bekannten Beziehung pOH + pH = 14 führen wir den pH-Wert ein:
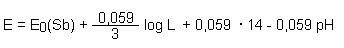
Durch Zusammenziehen der Konstanten wird die Gleichung verkürzt:
E = E0' - 0,059 pH
Bei pH = 0 ist E = E0'. Dies ist definitionsgemäß auch E0(Sb). Es gilt deshalb:
E = E0(Sb) - 0,059 pH
oder
E = - 0,443 - 0,059 pH (Volt)
Dies ist näherungsweise die Geradengleichung, die du aus dem obigen Bild erhältst.
Die Abweichungen ergeben sich daraus, dass du z. B. bei veränderlichen Temperaturen arbeitest. Bei der Titration wird schließlich Neutralisationswärme frei. Für genauere Untersuchungen hilft eine Pufferreihe weiter. Außerdem kann es Abweichungen dadurch geben, dass noch andere Gleichgewichte des Antimons eine Rolle spielen können.
Man spricht hier übrigens von einer Elektrode II. Art, da ihr Potential von einem dem Redoxgleichgewicht nachgeschalteten zweiten Gleichgewicht abhängt. Es ist deshalb auch keine Antimonelektrode im engeren Sinne, sondern eine Antimon/Antimonoxid/hydroxid-Elektrode.
Literatur zur Antimonelektrode:
G. Kortüm: Lehrbuch der Elektrochemie, Verlag Chemie, Weinheim 1966