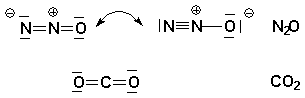|
Distickstoffmonoxid N2O
Entstehung - Verbrennungsprozesse, z. B. Waldbrände, Kokereien - Zwischenstufe bei der biologischen Nitrifikation bzw. Denitrifikation Technische Herstellung NH3 + HNO3 ———> 2 H2O + N2O Eigenschaften
(1) NH4NO3 ———> 2 H2O + N2O + Energie (2) N2O ———> N2 + ½ O2 (Chemieunfall Oppau 1921: 500 Tote) Verwendung
Umweltrelevanz
Spezifischer Treibhauseffekt 1 : 200 (2) Bildung von NOx durch Reaktion mit Ozon N2O + O3 ———> 2 NO + 2 O2 |