 |
| Schmelz- und Siedepunkte der Wasserstoffverbindungen der Sauerstoffgruppe |
Ein Blick ins PSE: Wenn Wasser wirklich nur H2O wäre
Das Periodensystem der Elemente
(PSE) erlaubt bekanntlich, aus der Stellung eines Elements in seiner Gruppe
auf seine Eigenschaften oder die seiner Verbindungen zu schließen.
Sauerstoff steht in der 6. Hauptgruppe. Um die
Besonderheit von Wasser zu erkennen, zieht man die analogen
Wasserstoffverbindungen von den anderen Elementen dieser Sauerstoffgruppe
heran, also Schwefel, Selen und Tellur.
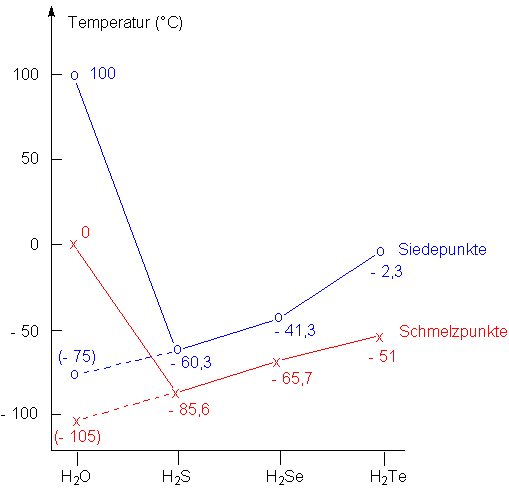
Das folgende Bild zeigt die Siedepunkte und die Schmelzpunkte von Wasser,
Schwefelwasserstoff, Selenwasserstoff und von Tellurwasserstoff. Wie zu erwarten,
steigen bei den letzten drei Verbindungen die Temperaturwerte mit der Atommasse
der Elemente an.
Nur Wasser macht eine große Ausnahme. Wäre Wasser ein normaler Stoff, so würde
die Kurve im folgenden Bild wie auf der gestrichelten Linie verlaufen. Wassereis würde bei -100
°C schmelzen und das flüssige Wasser bei -70 °C sieden.
Real liegt der Schmelzpunkt des Wassers jedoch um 100 °C höher, der
Siedepunkt sogar um 170 °C. Außerdem betrüge der Flüssigbereich nur 30 °C und
nicht 100 °C, wie in der Realität.
Der Grund ist, dass von den Verbindungen der 6. Hauptgruppe nur Wassermoleküle stabilere
Wasserstoffbrücken ausbilden. Deren Bindungsenergie liegt zwischen 15 und 45
kJ/mol. Das sind etwa 3-9 % der Energie der kovalenten Bindung zwischen O und H
(463 kJ/mol).
 |
| Schmelz- und Siedepunkte der Wasserstoffverbindungen der Sauerstoffgruppe |
Weitere Texte zum Thema „Wasser“