 |
Warum sind die Wassermoleküle überhaupt gewinkelt?
Sauerstoffatome haben sechs Valenzelektronen, von denen zwei zur Bindung mit den zwei Wasserstoffatomen, die jeweils ein Valenzelektron mitbringen, genutzt werden. Vier Elektronen bleiben als nichtbindende Elektronen zurück. Deshalb hat Sauerstoff um sich herum acht Elektronen versammelt. Jeweils zwei Elektronen besetzen eine Elektronenwolke, so dass es davon vier gibt.
Bezüglich der Anordnung dieser vier "Orbitale" gibt es zwei Möglichkeiten: Sie
könnten um das Sauerstoffatom herum ein flaches Quadrat oder ein räumliches
Tetraeder ausbilden.
Vergleicht man beide Strukturen, so erkennt man, dass sich die Elektronenwolken beim
Quadrat näher kommen als beim Tetraeder. Beim Tetraeder sind also die
größtmögliche Entfernung und damit die minimale Abstoßungs-Energie gewährleistet.
Das besagt das einfache Elektronenpaar-Abstoßungsmodell ("EPA").
Der Winkel ist nicht genau ein Tetraederwinkel, da die nichtbindenden Elektronenpaare
größere Orbitale bilden als die bindenden. Deshalb werden die bindenden
Elektronenpaare und damit auch die Wasserstoffatome etwas "zusammengedrückt".
Der Winkel beträgt statt 109,5 ° nur 104,5 °.
 |
Anstelle dieses einfachen Modells gibt es das Modell der Orbital-Hybridisierung,
das im Allgemeinen in der Schule nur mit der Kohlenstoffchemie in Verbindung
gebracht wird. Hierbei werden die kugelsymmetrischen s- und die drei hantelförmigen
p-Orbitale im Valenzzustand so gemischt, dass sie vier äquivalente, weit ausladende
Hybridorbitale (sp3) ergeben. Diese sind in die Ecken eines Tetraeders gerichtet. Im
Falle des völlig symmetrischen Moleküls von Methan schließen die Wasserstoffatome
den klassischen Tetraederwinkel von 109,5 ° ein.
Diese Hybridisierung findet jedoch nicht nur beim Kohlenstoff, sondern auch beim
Stickstoff und beim Sauerstoff statt. Für uns sind in diesem Zusammenhang vor allem
die Verbindungen Ammoniak und Wasser von Interesse. Die nichtbindenden
Elektronenpaare sind für die Basizität der Verbindungen verantwortlich. Deshalb
bilden auch die Molekül-Ionen NH4+ und H3O+ Tetraeder.
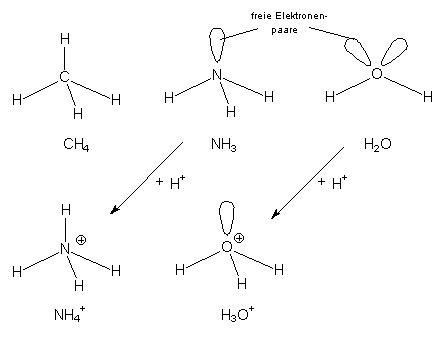
Die Moleküle CH4, NH3,
H2O, NH4+ und H3O+ im Vergleich
Weitere Texte zum Thema „Wasser“