6 Exemplarische Zusatzstoffe in Lebensmitteln
Eine Vorbemerkung: In diesem und dem nächsten Kapitel folgen wir in der Gliederung weitgehend W. Baltes.
6.1 Lebensmittelkonservierung
Um die Lebensmittel wird in unserer Welt ein verbissener Kampf zwischen den verschiedensten Organismen geführt. Lebensmittel sind aber nicht nur durch Fraß, sondern vor allem durch Fäulnis bedroht. Hierfür gibt es zwei Auslöser:
| - | Zersetzung durch Pilze und Bakterien
Dabei kommt es neben dem Verlust an Lebensmittelmasse auch zur Freisetzung von Schadstoffen:
| ||||||||
| - | Selbstzersetzung, Verwesung
Lebewesen bestehen aus strukturiertem Wasser. Die Struktur wird durch Polysaccharide oder Proteine aufrechterhalten. So besteht der harte Augapfel zu 99 % aus Wasser. Nach dem Tode laufen nur noch exotherme Abbauprozesse ab. Hierzu gehört der durch zelleigene Hydrolasen, vor allem durch Proteasen (Kathepsine) und durch DNAsen sowie RNAsen hervorgerufene Abbau der Makromoleküle. Die Folge ist das regelrechte Zerfließen der Organismen. |
6.2 Zugelassene Konservierungs-Methoden
6.2.1 Physikalische Konservierung
| - | Pasteurisieren
Kurzfristige Ultrahocherhitzung unter Druck soll Mikroorganismen abtöten und dabei empfindliche Nahrungsbestandteile (Vitamine) schonen. |
| - | UV-Strahlen
töten Mikroorganismen und auch höhere Tiere wie Milben ab. Die Behandlung ist unbedenklich. |
| - | Ionisierende Strahlen
Die Bestrahlung mit Röntgen- oder Gammastrahlen ist umstritten. Diese Eingriffe sind schon mit direkten chemischen Auswirkungen verbunden, da sie zur Bildung von Radikalen und Peroxiden in Lebensmitteln führen können. |
6.2.2 Physikochemische Konservierung
| - | Zusatz von wasserbindenden Stoffen
Beispiele sind Salz (Pökeln), Alkohol (Rumtopf), Zucker (Marmeladen) oder Fruchtsäuren. Diese Stoffe beeinträchtigen Mikroorganismen bzw. hydrolytisch wirkende Enzyme durch Eiweißdenaturierung oder einfach nur durch reversible Konkurrenz um das für die Funktion von lebensmittelabbauenden Hydrolasen notwendige Lösungsmittel Wasser. |
| - | Schockgefrieren
Das frische Lebensmittel wird in flüssigen Stickstoff (Temperatur: -196 °C) getaucht. Dabei bilden sich glasartige Eismodifikationen, die keine Volumenveränderung zeigen und damit das empfindliche Gewebe schonen. Nach dem Auftauen ist das Lebensmittel wieder "wie frisch". (Vergleichen Sie Ihre eigenen bei nur -20 °C eingefrorenen Erdbeeren mit den professionell konservierten nach dem Auftauen.) |
| - | Gefriertrocknung
Das schockgefrorene Lebensmittel wird in ein Vakuum gebracht. Dabei sublimiert das Gewebewasser unter Erhalt der Struktur fast vollständig ab. Das so getrocknete Lebensmittel kann wieder auf Normaltemperatur gebracht werden und ist (luftdicht verpackt und damit vor Feuchtigkeit geschützt) nahezu unbegrenzt haltbar. Nach Zugabe der entsprechenden Wassermenge ist die Speise wieder genießbar (Pulverkaffee, Eipulver und Instant-Food). Die so getrockneten Lebensmittel können durch Extraktion mit überkritischem CO2 von Cholesterin befreit werden. |
6.2.3 Zugelassene chemische Konservierung
Hier sind die weitaus meisten umstrittenen Verfahren zu finden. Die im Folgenden vorgestellten wichtigsten chemischen Konservierungsmittel werden einzeln oder als Gemische eingesetzt.
Sorbinsäure
Antimykotischer Naturstoff aus der Eberesche (Vogelbeere). Heute bevorzugt man seine technische Darstellung. Die Wirkdosis beträgt 0,01-0,3 % (bezogen auf die Masse des Lebensmittels). Da Sorbinsäure wie eine ungesättigte Fettsäure abgebaut wird, wird sie als unbedenklicher Stoff eingestuft.
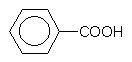
Benzoesäure

Diese einfachste aromatische Carbonsäure kommt als Naturstoff in größeren Mengen in der Preiselbeere vor. Sie wirkt undissoziiert, also in saurem Milieu antimykotisch.
p-Hydroxybenzoesäureester (PHB-Ester)
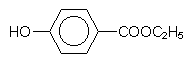
Wirkt gegen Pilze und zahlreiche Bakterien (Coliforme, Salmonellen).
Ameisensäure
Ameisensäure HCOOH ist als relativ starke Säure ein Antimykotikum.
Schwefeldioxid und Schweflige Säure
Schwefeln ist physiologisch nicht ganz unbedenklich: Ab 40 mg/l
Wein setzen z. B. die bekannten Kopfschmerzen ein. Die Wirkungsmechanismen
sind verschieden:
| - | Ab 20 mg/kg Lebensmittel beobachtet man antimykotische Wirkung. |
| - | Als Reduktionsmittel verhindert es die durch die Tyrosin-Oxidase ausgelöste oxidative Obstbräunung. In Trockenfrüchten (Apfelringe) ist es deshalb bis zu 2 g/kg enthalten. |
| - | Gleiches gilt für die Verhinderung der Maillard-Reaktion (-> 6.6.7). Hierunter versteht man die reduktive Bräunungsreaktion zwischen Proteinen und reduzierenden Zuckern beim Braten von Fleisch. |
Biphenyl und o-Phenylphenol
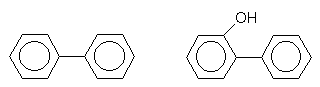
Dies sind die klassischen Spritzmittel gegen Grün- und Blauschimmel bei Citrusfrüchten. Man sieht beim Schälen deren schuppigen Kristalle. o-Phenylphenol ist weniger cancerogen als Biphenyl, da es eher wasserlöslich ist (-> 3.4.3).
Thiabendazol
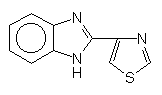
Es ist heute wohl das wichtigste Fungizid zum Schutz von Südfrüchten. Es wird als Kontaktgift von den Wurzeln der Bananenstaude oder Citrusbäume aufgenommen und in Früchte eingelagert, um Pilzen den Appetit zu verderben.
Rauchkonservierung
Viele leicht verderbliche Lebensmittel wie Aale, Kassler und
Schinken werden durch Räuchern konserviert.
Rauch enthält Stoffe (-> Abb. 42) wie Phenol (1), Kresol (2), Aldehyde (Formaldehyd (3), Acetaldehyd (4)) und Methanol (5), die alle gegen Mikroorganismen wirken, aber auch gegen den Menschen gerichtete Schadstoffe sind. Besonders bedenklich sind die cancerogenen polykondensierten Aromaten (PAK) wie 3,4-Benzpyren (6) und Anthracen (7).
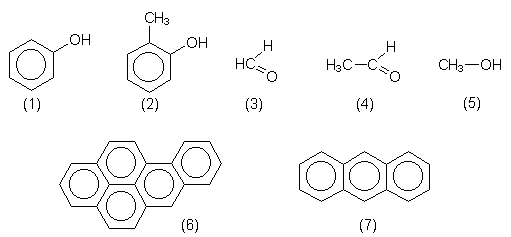
Abb. 42: Ausgewählte Inhaltsstoffe von Rauch
Nitrit und Nitrat
Das klassische Konservierungsverfahren ist das Pökeln.
Nitritpökelsalz enthält heute neben Natriumchlorid ca. 0,5 % Natriumnitrit
NaNO2 und zusätzlich eine größere (1-2 %) Menge an Kaliumnitrat
KNO3. In Rohschinken findet man leicht 150 mg/kg NaNO2 und
300-600 mg/kg KNO3.
Aus dem Nitrat wird reduktiv durch Bakterien unter reduzierenden Bedingungen Nitrit gebildet. Es stellt somit eine Oxidations- und Nitritreserve dar.
Zwei Wirkungsmechanismen sind beim Nitrit von Bedeutung:
| - | Umrötung des Fleisches
Rotes, instabiles Myoglobin (Mb) wird vor allem durch Erhitzen bei Sauerstoffanwesenheit zu grauem MetMb oxidiert (Farbe von hausgemachter Leberwurst):  Der stattdessen gebildete, ebenfalls tiefrote NO-Komplex ist
dagegen hitzestabil:
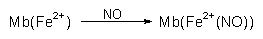 |
| - | Clostridien-Hemmung
Nitrit hemmt ganz besonders stickstofffixierende anaerobe Bakterien der Gattung Clostridium und damit auch den gefürchteten Auslöser der Lebensmittelvergiftung, C. botulinum. Wegen der Clostridienhemmung setzt man Nitrit auch dem Schnittkäse beim Reifen zu, um Fehlgärungen zu verhindern. Nitrit ist physiologisch keineswegs unbedenklich. Es greift u. a. das dem Mb chemisch ähnliche Hämoglobin (Hb) an. Ab 0,5 g/kg KNO2 Körpergewicht beobachtet man deshalb auch bei Erwachsenen Methämoglobinämie. Bei Kleinkindern tritt diese sog. Cyanose schon bei wesentlich geringeren Konzentrationen ein, da deren fetales Hb (FHb) wesentlich leichter oxidierbar ist. Beim Erhitzen in Gegenwart von Aminen bilden sich cancerogene Nitrosamine: 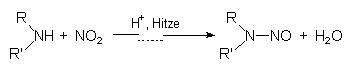 (Eine typische Speise mit hohem Nitrosamingehalt ist der Hawaii-Toast.) Fischwaren dürfen überhaupt nicht mit Nitrit behandelt werden, da sie besonders viel biogene Amine ("Geruch nach Fisch") enthalten. |
6.3 Nicht (mehr) zugelassene Konservierungsstoffe
Die folgenden Konservierungsmittel dürfen als physiologisch bedenkliche Stoffe in der BRD nicht mehr verwendet werden.
Antibiotika
Früher bekämpfte man Mikroorganismen in Lebensmitteln mit den
gleichen Antibiotika, die man auch gegen Infektionskrankheiten
einsetzte. Bald bemerkte man, dass die Antibiotika beim Kochen
nicht zerstört werden und Allergien sowie bakterielle Resistenz
(Hospitalismus) auslösten. Deshalb ist ihre Verwendung in der
Lebensmittelkonservierung zu Recht strikt verboten.
Ein Problem stellen allerdings die Antibiotika-Rückstände in Fleisch dar, die aus der Tierzucht stammen (-> 7.7).
Borsäure
H3BO3 dient zur Fisch-, Krabben- und Kaviarkonservierung. Sie
hemmt diverse Stoffwechselprozesse wie den Phosphat-Umsatz,
Vitamin B6 und damit die Metabolisierung von Aminosäuren. Dies
betrifft vor allem die Decarboxylierung, die zu fischig riechenden
biogenen Aminen führt (-> 3.5.2):
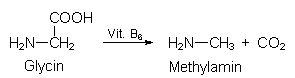
Aber auch die Bildung von irritierenden Aminen mit Gewebshormoncharakter wie die Histamine wird verhindert. Borsäure kumuliert allerdings im Gewebe von Menschen.
Bromessigsäure
Dieser oft in süßem französischen Wein enthaltene stark alkylierend
wirkende Stoff hemmt z. B. Enzyme, die im aktiven Zentrum eine
SH-, OH- oder NH2-Gruppe tragen. (Vergleichbar ist die Reaktion
von Lost; -> 3.4.3.) Dem Bier wird missbräuchlich die analog
wirkende Chloressigsäure zugesetzt.
Hexamethylentetramin
Diese auch Urotropin genannte Substanz dient auch heute noch in
Skandinavien und Osteuropa zur Konservierung von Salaten,
Meeresfrüchten und Mayonnaisen. Sie hydrolysiert unter
Wasseraufnahme langsam zu Ammoniak und Formaldehyd. Letzterer
reagiert mit funktionellen Gruppen wie -NH2, -SH und -OH und
hemmt deshalb Enzyme und Nucleinsäuren von Mikroorganismen.
Er steht im begründeten Verdacht, allergen zu sein.
Salicylsäure
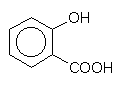
Diese aromatische Verbindung ist in der Weide (salix) enthalten, wirkt als Phenol und aromatische Carbonsäure fungizid, allerdings schwächer als Benzoesäure. Ihre Verwendung ist mittlerweile verboten, da Kumulation im Nervengewebe beobachtet wurde.
Wasserstoffperoxid
H2O2 ist nur als Bleichmittel zugelassen und ist deshalb als
Rückstand bedeutsam.
Ethylenoxid (Oxiran)
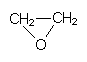
Als stark alkylierende Substanz dient die Grundsubstanz der Epoxide (-> Abb. 27) zur Schädlingsbekämpfung bei Trockenfrüchten. Nicht umgesetzte Reste dieses Gases können auch den menschlichen Stoffwechsel treffen; deshalb ist die Verwendung inzwischen verboten.
Hochwertige ungesättigte Verbindungen wie die fetten Öle oder Vitamine oxidieren leicht an der Luft (-> 3.2.4). Die Lebensmittel erleiden dabei Geschmackseinbußen und können durch Peroxid-, Epoxid- und Radikalbildung sogar toxisch werden.
Die einfachste Maßnahme ist Luftabschluss oder ein Schutzgas (-> 6.8). Den Weg, um dies chemisch zu verhindern, weisen die natürlichen Antioxidantien oder Reduktionsmittel. Hier findet man z. B. die Tocopherole (Vitamin E). Dies sind Hydrochinonderivate mit vielen Doppelbindungen in der Seitenkette (-> Abb. 29), die selbst leicht oxidierbar sind und den Sauerstoffgehalt in der Zellmembran verringern.
In der Lebensmitteltechnik greift man besonders gern auf die Ascorbinsäure sowie die fettlösliche 6-Palmitoyl-L-Ascorbinsäure zurück. Als leicht oxidierbare Phenole werden auch Gallussäureester eingesetzt. Sie fangen Sauerstoff und Peroxide ab.
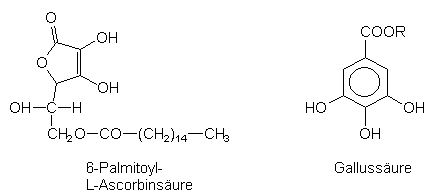
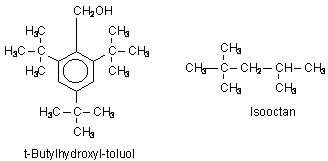
Bei vielen Reaktionen, an denen Peroxide beteiligt sind, bilden sich intermediär Radikale, die Lebensmittel zerstören können und - falls sie ausreichend stabil sind - auch den Konsumenten schädigen. Hiergegen setzt man selbst leicht Radikale bildende hochverzweigte Stoffe wie t-Butylhydroxy-toluol (BHT) ein, die andere Radikale abzufangen vermögen. In diesem Zusammenhang sei an das Antiklopfmittel Isooctan erinnert.
6.5 Stoffe zur Steuerung von Emulsionen
Hier fasst man drei Stoffgruppen zusammen, nämlich die insgesamt ähnlich wirkenden Emulgatoren, Eindicker (deren Produkt häufig eine Emulsion ist) und Stabilisatoren von Emulsionen sowie Feuchthaltemittel.
6.5.1 Emulgatoren
Emulgatoren lösen Grenzflächen durch Verringerung der Grenzflächenspannung zwischen zwei einander abweisende Phasen auf. Sie machen z. B. Wasser mit Öl mischbar. Dabei stellen sie kleinste, kolloidale Fetttröpfchen her, indem sie deren Oberflächen besetzen und Abstoßung bewirken.
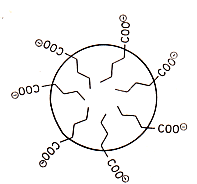
Abb. 43: Wirkung von Tensiden (Emulgatoren)
Sie sind im Allgemeinen polare Systeme wie die Seifen (die man nicht in der Lebensmitteltechnik verwendet, obwohl man von ihnen leben könnte) oder andere Tenside. Allerdings kann man hochwirksame Tenside wie z. B. die ungeladenen abbaubaren Saccharose-Fettsäureester nicht verwenden, da sie die Schleimhäute des Verdauungstrakts angreifen können.
Wichtige Emulgatoren sind Phosphate und Polyphosphate, Mono- und Diglyceride sowie die Lecithine (-> 3.2.1). Letztere bestehen aus Diglyceriden, verestert mit Phosphorsäure und mit Trimethylaminoethanol (Cholin; -> 7.1.1).
Beispiele für Anwendungen für Emulgatoren sind:
6.5.2 Gelierhilfen, Eindickungsmittel
Gel ist der verfestigte Zustand einer kolloiden Lösung (Sol). Gelierhilfen dienen zur Herstellung von Marmeladen, Saucen, Götterspeise oder Eis (ital. gelati). Oft sind Gelierhilfen zugleich Schaumbildner (z. B. in der Bratwurst). Sie verzögern - als hygroskopische Stoffe - die Austrocknung von Hot dogs oder Hamburgern.
Beispiele sind vor allem Polysaccharide und Gelatine. Zu den ersteren gehören Johannisbrotmehl (Guar), Agar, Alginat, Pektine (mit sauren -COOH-Gruppen), Gummi arabicum und chemisch veränderte Cellulose:
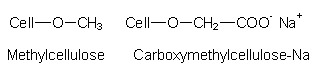
Sie binden als ca. 1 proz. Lösung 97-99 % Wasser (sog. strukturiertes Wasser; man denke daran, was von einer Qualle oder von Schneckenschleim nach dem Eintrocknen übrigbleibt).
6.5.3 Stabilisatoren
Stabilisatoren verhindern vor allem das Entmischen von proteinhaltigen Emulsionen oder Gelen, wobei sie mehr oder weniger direkt auf Proteine einwirken, deren Ausflocken sie verhindern.
Wichtig sind Phosphate, vor allem die Di- und Polyphosphate:
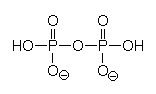
Deren Wirkung ist vielfältig:
| - | Phosphate sind gute Säure/Base-Puffer und verhindern so die Säure-Denaturierung von Proteinen. |
| - | Sie binden Ca2+-Ionen komplex wie
ein flüssiger Ionenaustauscher (frühere Rolle in Waschmitteln!)
und verhindern zur Ausflockung führende Protein-Ca2+-Protein-Bindungen,
indem sie selbst [Phosphat-Ca2+-Protein]-Komplexe bilden:
Abb. 44: Wirkung der Phosphate als Stabilisatoren Ein Beispiel ist das Milcheiweiß Casein, das besonders viel Ca-Ionen enthält. Man setzt deshalb dem Schmelzkäse, einer typischen Emulsion aus Milcheiweiß, Wasser und Fett, 0,2-0,5 % Polyphosphate zu. |
| - | Das Wasserbindungsvermögen von Lebensmitteln wird durch diese Phosphat-Ca2+-Protein-Komplexe stark erhöht. Dies betrifft z. B. Würstchen, aber auch den saftigen Schinken. |
| - | In Cola-Getränken ist Phosphorsäure zur Stabilisierung der Zuckercouleur-Emulsion enthalten. |
6.5.4 Feuchthaltemittel
Hierunter versteht man stark hygroskopische Verbindungen wie die Polyalkohole Glycerin oder Sorbit (letzterer besonders in Marzipan), die auch als Weichmacher von Folien auf Stärkebasis dienen können.
6.6 Geschmacksstoffe
Stoffe, die ausschließlich dazu dienen, den Geschmack zu verbessern oder ähnlich schmeckende Stoffe zu ersetzen, spielen in unserer Esskultur eine ganz besondere Rolle.
6.6.1 Kochsalz-Ersatzpräparate
Kochsalz NaCl ist das salzige Prinzip unseres Essens und in Grenzen lebensnotwendig zur Regulierung des osmotischen Drucks von Körperflüssigkeiten und Harn sowie für die Funktion von Nerven. Zuviel Kochsalz erhöht den Blutdruck. Als Ersatzstoff dient neben vielen anderen Kaliumverbindungen vor allem Kaliumglutamat.
6.6.2 Säuren
Säuren sorgen nicht nur für frischen Geschmack, sondern wirken auch fungizid. Typische Zusätze sind Essigsäure, Milchsäure und Fruchtsäuren wie Citronensäure.
In sauren Mineralwassern wie z. B. im Pyrmonter Säuerling ist Kohlensäure enthalten. Je mehr Na+- und Ca2+-Ionen ein Mineralwasser enthält, desto weniger sauer ist es. Diese stillen Wasser oder Sodawasser schmecken fast seifig.
Den Cola-Getränken setzt man neben Kohlensäure noch emulsionsstabilisierende Phosphorsäure zu.
Brausepulver ist eine Mischung aus Natriumhydrogencarbonat und fester, kristalliner Citronensäure bzw. deren Anhydrid. Beim Befeuchten setzen sie CO2 frei.
Potentielle Säuren sind saure Salze wie Ammoniumchlorid NH4Cl. Dieses ist bis zu 15 Gew.% in Salmiakpastillen enthalten ("Ammonium chloratum").
6.6.3 Zuckeraustauschstoffe
Glucose und Saccharose sind für Diabetiker gefährlich, da sich Glucose bei Insulinmangel im Blut anreichert. Der Grund ist, dass Insulin bei der phosphorylierenden Einschleusungsreaktion des Traubenzuckers mitwirkt. Man sucht deshalb nach verstoffwechselbaren süßen Ersatzstoffen, die auch ohne Phosphorylierung die Zellmembran passieren können:
Fructose
Dieser Zucker, der auch an der Glykolyse beteiligt ist, ist sogar
noch süßer als Saccharose und wandert sofort aus der Blutbahn
in die Zellen.
Zuckeralkohole
Das süß schmeckende Glycerin ist zu hygroskopisch und zusätzlich
flüssig. Aus Glucose gewinnt man durch Reduktion den
kristallinen Sorbit, aus Pentosen des Holzes den Xylit. Beide
schmecken süß und werden nur langsam resorbiert. Xylit wird im
Pentosephosphatzyklus unter Bildung von Ribose und Desoxyribose
verstoffwechselt. Zuckeralkohole haben nur den Nachteil,
dass sie als hygroskopische Stoffe laxierend wirken.
Glycin
Diese Aminosäure schmeckt - wie der Name sagt - ebenfalls süß.
(In diesem Zusammenhang sei erwähnt, dass auch einige Metallsalze
wie Mangansulfat, Bleiacetat ("Bleizucker") oder Berylliumnitrat
süß schmecken.)
6.6.4 Süßstoffe
Heute ist es modern, sog. "light"-Lebensmittel zu sich zu nehmen, in dem Glauben, etwas für die Gesundheit zu tun. Bei diesen Lebensmitteln ersetzt man den natürlichen Zucker durch medikamentartige Chemikalien, lässt aber die anderen, nicht unbedingt unschädlichen Stoffe (wie Coffein oder Phosphorsäure in Colagetränken) unangetastet.
Palatinit
Hydrierte und isomerisierte Saccharose, die süß schmeckt, aber
nicht resorbiert wird.
Saccharin
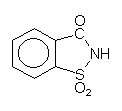
Diese Substanz ist seit 100 Jahren bekannt. Sie besitzt eine wesentlich stärkere Süßkraft als Saccharose. Der Verdacht auf Cancerogenität hat sich nicht bestätigt. Allerdings gilt er für eine Synthesevorstufe. Toxizität bzw. Cancerogenität ist also oft eine Frage der Sorgfalt bei der Herstellung und Reinigung des Produkts.
Cyclamat
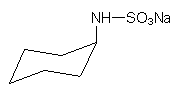
Diese Substanz (Na-Cyclohexylaminsulfamid) wurde 1970 in den USA verboten. In der EG ist sie noch zugelassen. Die Abbaustufe Cyclohexylamin verursacht bei Ratten Fertilität und Schäden im Nervensystem.
Dulcin
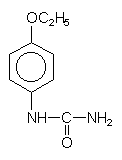
Dieses aromatische Harnstoffderivat ist als Aminobenzolderivat nicht mehr zugelassen.
Aspartam
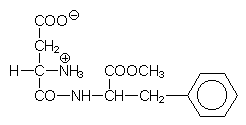
Das Dipeptid ist aus Asparaginsäure und Phenylalanin(methylester) zusammengesetzt. Bei uneingeschränktem Gebrauch besteht Gefahr für Menschen, die unter der genetisch bedingten Phenylketonurie leiden.
6.6.5 Bitterstoffe
In Tonic Waters findet man bis 80 mg/l Chinin. Diese Getränke erfrischen nicht nur, sondern galten in den Kolonien auch als Malariaprophylaxe.
6.6.6 Geschmacksverstärker
Um fade Nahrungsmittel attraktiver zu machen und Geschmack vorzutäuschen, setzt man Geschmacksverstärker ein. Einige Beispiele:
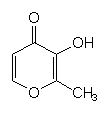
Karamel in Süßspeisen
Karamelpudding schmeckt süßer als Vanillepudding. Bei der
Karamelisierung entsteht unter anderem Maltol (siehe nächste Formel),
ein zyklischer ungesättigter Ether. Karamel-artige Verbindungen sind als brauner Farbstoff
auch in Colagetränken enthalten („Zuckercouleur“).
Suppen- oder Speisenwürze mit Fleischgeschmack
Schon seit 1820 ist bekannt, dass man mit Mineralsäuren Proteinreste
(Knochenleim, Gelatine) partiell hydrolysieren kann. Dieses
Verfahren wurde von Julius Maggi ab 1883 wirtschaftlich genutzt.
(Verfahren, auch aus dem nachwachsenden Rohstoff Haar eine
Suppenwürze zu gewinnen, waren in Japan erfolgreich. Dies ist
besonders bemerkenswert, weil der Hauptgeschmacksstoff von
Fleischwürzen das in Haarproteinen reichlich enthaltene Cystein
ist.)
Zur Herstellung von Sojawürze werden Reste von Sojamehl, dem man zuvor durch leichtflüchtiges Benzin die Lipide entzogen hat, mehrere Stunden bei einer Temperatur über 100 °C in Salzsäure gekocht und anschließend mit Natronlauge neutralisiert (bei natriumarmen Würzen mit Calciumcarbonat). Kochsalz ist ein zusätzlicher Geschmacksfaktor und bewahrt die Würze vor Befall durch Mikroorganismen.
In Suppenwürze ist als geschmacksbildender Stoff Natriumglutamat enthalten. Vor allem in den asiatischen Speisen findet man Glutamat zu 0,1-0,3 %. Zuviel Glutamat löst das China-Restaurant-Syndrom aus. (Diese bekannten Schweißausbrüche haben also nichts mit der Rechnung zu tun.)
Auch Pilze sind bekannte Fleischgeschmacksverstärker. Ihre Wirkstoffe sind Ribonucleotide wie IMP und GMP.
6.6.7 Maillard-Stoffe
Erhitzt man bestimmte Aminosäuren zusammen mit Glucose, erhält man typische Geschmackseindrücke. Beispiele sind:
| Aminosäure | Aroma |
| Cystein | gebratenes Fleisch |
| Methionin | gebackene Kartoffel |
| Leucin | Schokolade
überbackener Käse (stärkere Hitze) |
6.7 Farbstoffe
Viele Lebensmittel wie z. B. Konfitüre, Lachsersatz, Pudding und Gummibärchen (die aus gelblicher Gelatine bestehen) müssen attraktiv gemacht werden. Deshalb setzt man ihnen Farbstoffe zu. (Dies ist nicht zu verwechseln mit der Umrötung von Fleisch durch Nitrit.)
Farbstoffe sind hoch ungesättigte chemische Verbindungen, die Licht im sichtbaren (VIS-)Bereich absorbieren. Die Mischung des nicht absorbierten Teils des weißen Lichtes ergibt den Farbeindruck.
6.7.1 Natürliche Farbstoffe
Man färbt direkt mit den Säften oder gewinnt zuvor die Farbstoffe. Beispiele sind:
| - | Kirschsaft oder Rotkohlsaft (Anthocyane)
Deren Farbeindruck ist pH-abhängig. Diese Stoffe können deshalb als Säure/Base-Indikatoren dienen, wie das Paar Rotkraut/Blaukraut zeigt. |
| - | Rote Bete-Saft (Betanin)
Der Farbstoff ist hitzeempfindlich. Hiermit färbt man z. B. Heringssalat. Betanin wird kaum resorbiert (Vortäuschen von Blut im Stuhl). |
| - | Safran und Crocetin
sind in Krokus enthaltene gelbe Farbstoffe. |
| - | Vitamin B2
ist ebenfalls ein gelber Farbstoff. |
| - | Mit Curcumin
aus der Curcumapflanze färbt man Currypulver. |
| - | Carotinoide
Diese gelben bis tiefroten Farbstoffe sind fettlöslich und deshalb besonders geeignet zum Anfärben von Margarine (die ohne Emulgator und Farbstoff wie Vaseline oder Abschminkcreme aussieht) sowie von Winterbutter. Das orangefarbene b-Carotin hat den zusätzlichen Vorteil, dass beim Abbau Vitamin A gebildet wird. Andere als Lebensmittelfarben zugelassene Carotinoide sind z. B. das rote Lycopin (Tomate, Paprika) sowie das gelbe Lutein (Eidotter) und Zeaxanthin (Mais). Diese finden sich auch als Zusätze im Lebendtierfutter (Goldfische, Flamingos, Hühner für gelbes Eidotter). Das Rot der gekochten Krebse ist ebenfalls ein carotinoider Farbstoff. |
| - | Cochenille
Dieser Farbstoff (ein dem Alizarin aus der Krappwurzel ähnlicher Anthrachinonfarbstoff) wird aus der Kaktuslaus gewonnen und ist ein rein tierisches Produkt. Es spielt auch in der Kosmetik als Farbstoff des Lippenstifts eine gewisse Rolle.
Abb. 45: Natürliche Farbstoffe, ß-Carotin (1), Betanin (2) und Cyanidin-chlorid (3) |
6.7.2 Anorganische Farbstoffe
Die Schwärzung von Schinken zum Vortäuschen des Räuchervorgangs kann mit Aktivkohle erfolgen. Einreiben mit Ruß ist dagegen gesundheitlich bedenklich.
6.7.3 Künstliche Farbstoffe
Deren Verwendung ist umstritten, handelt es sich bei ihnen doch stets um aromatische Verbindungen. Seit man weiß, wie manche aromatische Verbindungen im Körper bei der Vorbereitung zur Ausscheidung durch Epoxidierung zu Cancerogenen werden können, greift man auf wasserlösliche Farbstoffe zurück, die sehr intensiv getestet wurden.
Erinnert sei an das 1938 verbotene Buttergelb, einem fettlöslichen Margarinefarbstoff, der Leberkrebs auslösen kann. Im Gegensatz zu ihm ist Methylorange ein ungiftiger Indikator. Grund ist die Wasserlöslichkeit (-> 3.4.3):
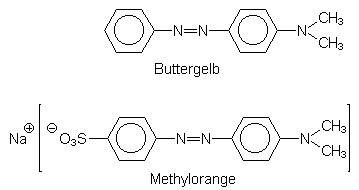
Viele Farbstoffe werden gar nicht resorbiert (wie Betanin) oder unverändert über den Harn ausgeschieden.
In der E-Liste der erlaubten Zusatzstoffe ist eine lange Reihe synthetischer Farbstoffe aufgeführt. Einige Beispiele:
| - | Kupferhaltige Chlorophyllanaloge. |
| - | Azoverbindungen |
| - | Tartrazin
(das Gelb von Gummibärchen) steht wie die meisten Azoverbindungen im Verdacht, allergen zu wirken. 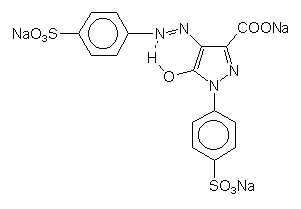 |
| - | Amaranth
(Rot-3; E 123) steht in der USA im Verdacht, cancerogen zu sein. In der EG bestehen diese Bedenken nicht, da sich die US-Versuche nicht reproduzieren ließen. 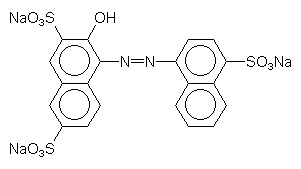 |
| - | Zuckercouleur
Dies ist ein hochpolymeres kolloidales Zersetzungsprodukt von Zucker, welches vor allem in Cola-Getränken oder Backwaren verwendet wird. Zuckercouleur selbst ist unbedenklich. Allerdings werden bei der Herstellung Bräunungsbeschleuniger zugesetzt. Beispiele sind: Soda Na2CO3, Kalilauge KOH, Ammoniak NH3, Schwefelsäure H2SO4, Citronensäure, Phosphorsäure H3PO4 (u. v. a. m.). Mit Ammoniak bilden sich möglicherweise cancerogene Stoffe. |
6.8 Weitere Zusatzstoffe
Die Phantasie der Lebensmittelindustrie, ihre Produkte gefälliger zu gestalten, ist unerschöpflich. Die entsprechenden Anstrengungen sind aber oft mit dem Zusatz von Stoffen verbunden. Hier zum Abschluss eine kleine Auswahl:
| - | Schutzgase
Der Zusatz von Gasen wie Stickstoff oder CO2 bei gleichzeitigem Luftabschluss verhindert Oxidation oder Feuchtigkeitsaufnahme (z. B. Pulverkaffee). |
| - | Treibgase
Sahnesiphons enthalten Distickstoffoxid N2O, ein stabiles Treibhausgas mit 250fach stärkerer Wirkung als CO2. Letzteres ist ebenfalls ein Treibgas (z. B. in Wassersiphons). |
| - | Wachsüberzüge
Käse und Trockenfrüchte werden in dicke Paraffinschichten verpackt. (Frische blaue Weintrauben enthalten ähnliche Überzüge.) |
| - | Klärhilfsmittel
Mit Silicaten wie Bentonit sowie mit Aktivkohle adsorbiert man Schwebeteilchen. Rotwein enthält Eisenverbindungen, die leicht ausflocken und den Wein trüben. Dies verhindert man durch den Zusatz von genau dosiertem Kaliumhexacyanoferrat(II), das Eisen(III)-Ionen als abtrennbares Berliner Blau bindet (Blauschönung). |
| - | Ethylen
Dieses einfachste Alken ist ein Gas, das von vielen reifenden Früchten beim Reifevorgang produziert wird und andere Früchte ansteckt sowie Kartoffeln zum Keimen anregt. Es wird gezielt als Reifungshilfe bei Bananen eingesetzt (Motto: "Innen grün, außen gelb"). |
| - | Benzaldehyd und andere benzoide Aromastoffe
Wie viele aromatische Verbindungen ist auch der einfachste Benzolaldehyd ein Aromastoff (daher der Name der gesamten Verbindungsklasse). Er riecht marzipanartig und ist der Duftstoff der Mandeln. Der Zusatz als Mandelersatzstoff bei der Herstellung von Marzipan oder Weihnachtsstollen ist üblich. Ein anderer aromatischer Stoff, der heute aus Lignin künstlich hergestellt wird, ist das Vanillin. Weiter ist das Anisol (aus Anis oder Fenchel; in Getränken wie Pernod, Uzo, Raki oder Aquavit enthalten) zu nennen. Anisol bzw. der entsprechende Aldehyd p-Anisaldehyd ist auch der Geruchstoff des echten Waldchampignons. 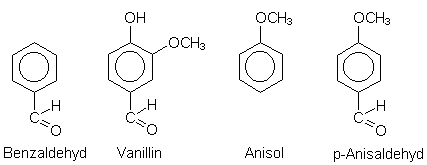 |
| - | Fruchtester
Ester sind Verbindungen zwischen Fettsäuren und Alkoholen. Die einfachen Ester weisen ein überraschendes Duftspektrum auf. Einige Beispiele: 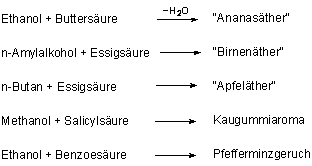 |