
4 Chemische Bindung
Chemische Bindungen entstehen durch Austausch von Valenzelektronen zwischen den Atomen.
Dieser Austausch kann vollständig sein (Ionenbindung; Beispiele sind Natriumchlorid NaCl, Aluminiumoxid Al2O3).
Der Austausch kann auch unvollständig sein und zum gemeinsamen Besitz von zwei oder mehr Elektronen führen (kovalente Bindung oder Atombindung; Beispiele sind Chlor Cl2, Methan CH4, Kohlendioxid CO2, Stickstoff N2).
Dazwischen gibt es den Übergang der polarisierten Atombindung, z. B. bei H2O, NH3, HCl, SO2 sowie Ethanol CH3-CH2OH.
Hinzu kommen noch Bindungen höherer Ordnung wie van der Waals- und Wasserstoffbrückenbindungen. Auch Komplexe (-> 15) sind hier einzuordnen.
4.1 Elektronegativität (EN)
Die Richtung des Elektronentransfers, d. h. welches Element die Elektronen abgibt und welches sie anzieht oder aufnimmt, hängt von der so genannten Elektronegativität ab.

Tab. 6: Elektronegativitäten der wichtigsten Elemente
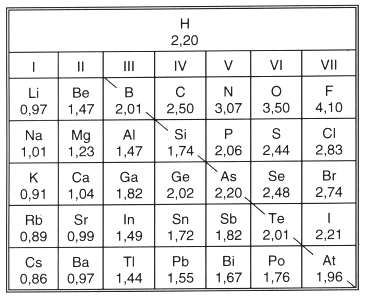
Unter EN versteht man das Bestreben eines Elementes, Elektronen zu sich heranzuziehen. Der EN-Wert (-> Tab. 6) bzw. die Differenz zweier EN-Werte sagt etwas aus über die relative Reaktivität eines Elementes im Vergleich zu einem anderen. (Mit dieser Eigenschaft sind auch Redoxphänomene eng verbunden; -> 13.)
Innerhalb einer Elementgruppe nimmt die EN von oben nach unten ab. So nimmt Chlor eher Elektronen auf als Iod. Deshalb vertreibt Chlor Iod aus seinen Bindungen:
Cl2 + 2 I ¯ ———> 2 Cl¯ + I2
Nichtmetalle und Metalle unterscheiden sich signifikant im EN-Wert:
Im Folgenden wird an einigen Beispielen gezeigt, wie sehr die Elektronegativität mit chemischen Phänomenen übereinstimmt.
Nichtmetalle
Iodid kann durch Sauerstoff zu Iod reagieren:
½ O2 + H2O + 2 I¯ ———> 2 OH¯ + I2
Sauerstoff wird von Fluor aus dem Wassermolekül ausgetrieben:
F2 + H2O ———> 2 HF + ½ O2
Die Reihenfolge der Nichtmetalle, bezogen auf die EN, ist somit F-O-I.
Die EN-Werte sagen auch etwas über die Toxizität der Nichtmetalle aus. So ist Fluor das weitaus giftigste Nichtmetall, gefolgt vom Chlor (Bademeisterunfall). Iod ist weniger giftig; es diente deshalb früher als Wunddesinfektionsmittel (Iodtinktur). Sauerstoff ist ein Zellgift.
Metalle verhalten sich bezogen auf die EN umgekehrt. Edlere, aber kaum reaktionsbereite Metalle haben eine höhere EN als die weniger edlen, d. h. sie streben an, aus den Verbindungen in den metallischen Zustand überzugehen. Deshalb kann man z. B. mit Natriummetall Aluminium aus seinen Verbindungen gewinnen:
3 Na + AlCl3 ———> 3 NaCl + Al
Mit Aluminium befreit man Eisen aus Eisenoxid (Thermitverfahren):
2 Al + Fe2O3 ———> Al2O3 + 2 Fe
Mit Eisen setzt man Kupfer aus Kupfersalzlösungen frei (Zementieren):
Fe + Cu2+ ———> Fe2+ + Cu
Die Reihenfolge der Metalle bezogen auf die EN ist also Cu-Fe-Al-Na. (EN Fe = 1,8, Cu = 1,9.)
Die Differenz der EN-Werte gibt Aufschluss über den Bindungstyp. Ist die EN-Differenz sehr groß, so liegt eine Ionenbindung vor (z. B. NaCl). Ist sie klein, resultiert eine polare Atombindung (z. B. HCl). Ist die EN-Differenz gleich Null, liegt eine unpolare Atombindung vor (z. B. Cl2).
4.2 Ionenbindung. Wertigkeit (Oxidationszahl)
Leitet man Chlorgas über geschmolzenes Natrium, so reagieren beide Stoffe heftig unter Flammenerscheinung miteinander. Es entsteht ein weißes, kristallines Pulver, Natriumchlorid NaCl, bekannt als Kochsalz:
Na + ½ Cl2 ———> Na+ + Cl¯ + Energie
Im Verlauf der Reaktion übertragen Natriumatome je ein Elektron auf die Chloratome. Es entstehen positiv geladene Natrium-Ionen und negativ geladene Chlorid-Ionen, die durch elektrostatische Kräfte in einem Ionengitter zusammengehalten werden.
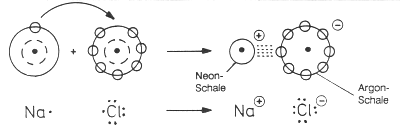
Abb. 4: Bildung von Kochsalz aus Natrium und Chlor
Warum wird bei dieser Reaktion nur ein Elektron übertragen? Die Elemente streben an, die Elektronenkonfiguration
der am nächsten gelegenen Edelgasschale zu erreichen. Diese ist energetisch besonders stabil (wie die geringe Reaktivität
der Edelgase zeigt).
Das sehr reaktive Metall Natrium hat ein Valenzelektron, das sehr reaktive Chlor sieben. Dagegen haben die gebildeten Ionen vollbesetzte Schalen mit jeweils acht Valenzelektronen: Das Na+-Ion hat die Edelgasschale von Neon, das Cl¯-Ion die von Argon. Analog zu den wenig reaktiven Edelgasen sind deshalb auch die Natrium- und Chlorid-Ionen sehr stabil, nicht mehr reaktiv und nicht so giftig wie die Elemente.
Die Ionenbildung der übrigen Elemente erfolgt nach folgender Regel: Die Zahl der ausgetauschten Elektronen kann man der Gruppennummer im Periodensystem entnehmen; man spricht hierbei von Wertigkeit.
Vorausgreifend sei gesagt, dass man anstelle der Wertigkeit besser von der Oxidationszahl spricht (-> 13). Damit gibt man an, wie viele Elektronen abgegeben (positive Ladungszahl) oder aufgenommen wurden (negative Ladungszahl). Man verwendet für die Ladungszahl römische Ziffern.
Merkt man sich, dass H (bis auf seltene Ausnahmen) in Verbindungen stets die Oxidationszahl +I hat, kann man die Oxidationszahlen der übrigen Elemente herleiten. Gleiches gilt für Sauerstoff, der meistens die Oxidationszahl -II hat. Beispiele: H2O, HCl, Na2O oder Al2O3.
Elemente haben die Oxidationszahl 0. Dies gilt auch dann, wenn zwei oder mehr Atome eines Elements untereinander verbunden sind. Beispiele sind Cl2, N2 oder C im Graphit, Ruß, Fulleren oder Diamant.
Natürlich kann ein Element in seinen Verbindungen in verschiedenen Oxidationszahlen vorliegen. Ein Beispiel für die wechselnde Oxidationszahl ist der Sauerstoff: Element O2 (Oxidationszahl 0), Wasser H2O (-II), Wasserstoffperoxid H2O2 (-I), Hydroxylradikal OH (-I) und Ozon O3 (0). Aber auch Eisen zeigt unterschiedliche Oxidationszahlen: Metall (0), in eutrophierten Gewässern als Fe2+ (+II) und in sauerstoffreichem Milieu Fe3+ (+III).
Einige Beispiele für die Oxidationszahlen der zentralen Elemente in verschiedenen Verbindungen gibt die folgende Übersicht:
| Verbindung | Formel | Zentralatom | Oxidationszahl |
| Chlorwasserstoff | HCl | Cl | -I |
| Natriumhypochlorit | NaClO | Cl | +I |
| Chlordioxid | ClO2 | Cl | +IV |
| Schwefelsäure | H2SO4 | S | +VI |
| Kaliumpermanganat | KMnO4 | Mn | +VII |
| Kaliumdichromat | K2Cr2O7 | Cr | +VI |
| Phosphorsäure | H3PO4 | P | +V |
| Salpetersäure | HNO3 | N | +V |
| Methan | CH4 | C | -IV |
| Kohlendioxid | CO2 | C | +IV |
Die Bindung zwischen Natrium und Chlor kommt letztlich dadurch zustande, da die gegensätzlich geladenen Ionen sich anziehen. Es bilden sich Ionengitter aus (-> Abb. 5). Die Bindung ist sehr stark. Folglich haben Salze und Oxide im Allgemeinen sehr hohe Schmelzpunkte (NaCl: 801 °C, Al2O3: 2045 °C).
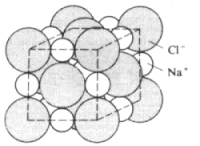
Abb. 5: Modell des Kristallgitters von Kochsalz NaCl
Ionisch aufgebaute Verbindungen nennt man auch Elektrolyte, da sie in Schmelze oder Lösung den elektrischen
Strom leiten. Man findet unter ihnen Salze und Oxide sowie Säuren und Laugen (-> 14).
4.3 Atombindung (Elektronenpaarbindung, kovalente Bindung)
Mit Ausnahme der Edelgase bilden alle Nichtmetalle mehr oder weniger große Moleküle. So besteht Chlor nicht aus einzelnen Atomen, sondern liegt molekular als Cl2 vor:
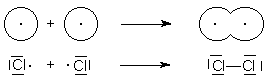
Abb. 6: Bildung einer Einfachbindung
Um die Edelgasschale zu erreichen, benötigt jedes Chloratom ein Elektron, deshalb wird ein Elektronenpaar von beiden
Chloratomen gleichzeitig benutzt: Man spricht von Elektronenpaarbindung.
Weitere Beispiele für kovalente Einfachbindungen in Elementen sind Fluor (F2) und Wasserstoff (H2) sowie Kohlenstoff (C) im Diamantgitter.
Dem Sauerstoffatom fehlen zur Edelgaskonfiguration 2 Elektronen. Es bildet sich eine Doppelbindung (Diese ist allerdings als Biradikal angelegt; -> 5.):
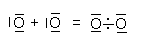
Abb. 7: Sauerstoffatom und -molekül
Dem Stickstoffatom fehlen 3 Elektronen zur Edelgaskonfiguration. Demzufolge bilden sich drei Elektronenpaarbindungen aus,
eine Dreifachbindung:
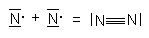
Abb. 8: Stickstoffatom und -molekül
Ein Beispiel für kovalente Einfachverbindungen aus unterschiedlichen Atomen ist Methan CH4 (Erdgas). Das
Molekül ist tetraedrisch aufgebaut:
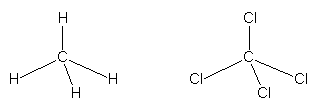
Abb. 9: Aufbau von Methan und CCl4
Analog ist das Tetrachlormethan CCl4 ("Tetra") aufgebaut. Methan und Tetra sind völlig symmetrische Moleküle
und daher unpolar.
Die Geometrie der Moleküle von Ammoniak NH3 und Wasser ist als Ausschnitt aus einem Tetraeder zu verstehen. Gleiches gilt für das H3O+-Ion. Das Ammonium-Ion NH4+ ist wieder tetraedrisch aufgebaut.
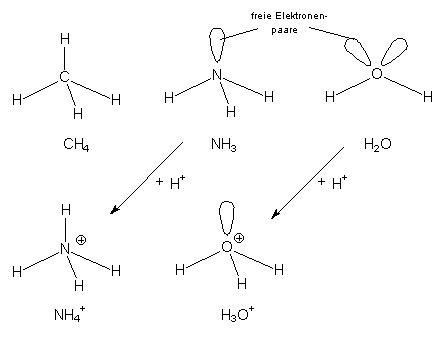
Abb. 10: Die Moleküle CH4, NH3, H2O, NH4+, H3O+ im Vergleich
Im Kohlendioxid CO2 ist das C-Atom zweifach doppelt gebunden. Das Molekül ist linear. Genauso sieht das
andere Treibhausgas Distickstoffoxid N2O aus:
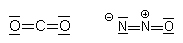
Abb. 11: Molekül von Kohlendioxid und Distickstoffoxid
Allerdings gibt es auch kovalent aufgebaute Kristalle; das schönste Beispiel hierfür ist der Diamant, das mengenmäßig
wichtigste aber ist der Quarz. Letzterer hat wegen der starken Bindungskräfte einen Schmelzpunkt von 1510 °C.
4.4 Polarisierte Atombindung, Wasserstoffbrückenbindungen
Die Elektronenpaare, die für die kovalente Bindung zwischen zwei verschiedenen Elementen benötigt werden, sind zwischen den Bindungspartnern nicht immer gleichmäßig verteilt, d. h. die Elektronenpaarbindung ist polarisiert. Dies liegt daran, dass die Elemente unterschiedliche Elektronegativitäten besitzen. Ein Beispiel der Chlorwasserstoff (HCl).
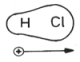
Abb. 12: Dipoleigenschaften von HCl
Kovalente Bindungen symmetrischer Moleküle sind sehr stark und sind nur im Molekül, also intramolekular wirksam.
Die resultierenden intermolekularen Bindungskräfte sind deshalb im allgemeinen relativ schwach; folglich sind
niedermolekulare kovalente Verbindungen bei Raumtemperatur häufig gasförmig, flüssig oder haben niedrige
Schmelzpunkte. Für Salze gilt das Gegenteil: Sie sind fest und haben hohe Schmelzpunkte.
Polare Moleküle sind dagegen elektrische Dipole (Symbol +->), die sich untereinander anziehen. Wasser und Ammoniak (NH3) sind wichtige Beispiele. Die in sich symmetrischen Moleküle von Ammoniak und Wasser sind wegen der unterschiedlichen EN und der zusätzlichen molekularen Unsymmetrie polar und sogar ausgeprägte elektrische Dipole (-> Abb. 12). Hierauf beruht ihr gutes Lösungsvermögen für andere polare Substanzen und Ionen.
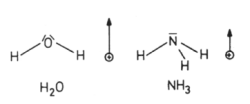
Abb. 13: Dipoleigenschaften von H2O und NH3
Die für die Umwelt wichtigste Auswirkung der polarisierten kovalenten Bindung wird an den Eigenschaften von Wasser
deutlich:
Wasser hat eine relativ hohe Schmelz- und Siedetemperatur, obwohl es als sehr kleines Molekül nur kovalente Bindungen enthält. Man vergleiche es mit den weniger polaren und daher gasförmigen Verbindungen Ammoniak NH3, dem schweren, unpolaren Molekül Schwefelwasserstoff H2S oder der Blausäure HCN.
Es muss also eine zusätzliche Bindungsart geben, die im Falle der Änderung von Aggregatzuständen zu überwinden ist. Dies sind die intermolekularen Wasserstoffbrücken- oder H-Brückenbindungen. Sie beruhen auf Dipolkräften, die immerhin etwa 1/5 der Stärke von kovalenten Bindungen ausmachen können. Diese bilden sich nicht nur zwischen Wassermolekülen aus, sondern auch mit den OH- sowie NH2-Gruppen von Alkoholen, Zuckern, Aminosäuren oder Proteinen. Daher lösen sich diese Stoffe sehr gut in Wasser. ("Gleiches löst sich in Gleichem".)
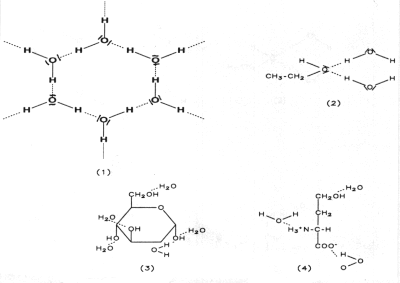
Abb. 14: Wasserstoffbrückenbindungen zwischen Wassermolekülen (1),
Ethanol/Wasser (2), Glucose/Wasser (3) und Aminosäure/Wasser (4)
Intramolekulare H-Brücken zwischen den NH- und den CO-Gruppen der Peptidkette formen Proteine (sog. Sekundärstruktur).
Auch die Doppelhelix der DNS wird durch Wasserstoffbrücken zusammengehalten.
Mit Dipolkräften lässt sich auch die hervorragende Löslichkeit von Salzen und anderen Elektrolyten in Wasser erklären: Elektrische Dipole vermögen gegensätzlich geladene Ionen zu trennen, indem sie sich dazwischen schieben:
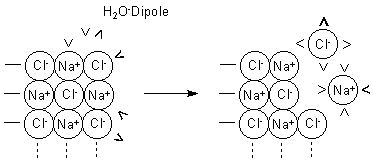
Abb. 15: Lösung eines Ionenkristalls in Wasser
Dies gilt auch für die Dissoziation von Säuren und Basen in wässrigen Lösungen. So wird Chlorwasserstoff erst in Verbindung
mit Wasser zur Salzsäure:
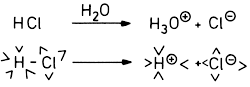
Abb. 16: Irreversible Dissoziation von HCl
Gleiches gilt für die Base Ammoniak:
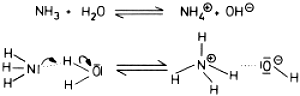
Abb. 17: Reversible Laugenbildung durch NH3 in Wasser
4.5 Van der Waalsche Bindung
Einzelne Atome wie die der Edelgase oder Moleküle von kovalenten Verbindungen wie Methan sind häufig völlig unpolar, sollten also über keinerlei Anziehungskräfte verfügen und sich beispielsweise nicht verflüssigen lassen. Diese Verbindungen lassen sich jedoch sogar kristallisieren. Beispiele hierfür sind Iod (I2; Schmelzpunkt 113,6 °C) oder Benzol (C6H6; Schmp. 5,5 °C), Stickstoff (N2; Schmp. -210 °C) und sogar die Edelgase wie Helium (He; Schmp. -272 °C). Kohlenstoffdioxid sublimiert bei -72 °C. Die Anziehungskräfte zwischen den Molekülen beruhen auf geringen zeitlichen Ungleichverteilungen der Elektronen in den Molekülen. Diese so genannten van der Waalschen Bindungen sind wesentlich schwächer als die Ionen- oder Atombindungen. Sie sind andererseits aber auch Grundlage für das gute Fettlösungsvermögen von Benzin, Tetrachlormethan und den FCKW, aber auch von Benzol oder überkritischem CO2.
Van der Waals-Anziehungskräfte treten auch bei der physikalischen Adsorption von Gasen oder Feststoffen an unpolaren Adsorptionsmitteln auf. Beispiel ist das Recycling von unpolaren Lösemitteln wie CKW durch Adsorption an Aktivkohle (-> 7.3).
4.6 Metallische Bindung. Legierungen
Metalle bestehen aus Kristallen, deren Gitter aus Metall-Ionen aufgebaut sind. Zwischen diesen sind die Elektronen frei beweglich ("Elektronengas"). So erklären sich die typischen Metalleigenschaften wie elektrische Leitfähigkeit, Wärmeleitfähigkeit, metallischer Glanz und Verformbarkeit.
Grund für die leichte Verformbarkeit ist, dass sich die gleichgeladenen Ionenschichten leicht gegeneinander verschieben lassen. Reines Eisen ist als weicher Blumendraht bekannt, Kupfer lässt sich zu Litze verspinnen und Zinn (obgleich es grobkristallin ist) leicht verbiegen. Gibt man andere Metalle hinzu, so können sich die Eigenschaften in diesen Legierungen drastisch verändern. Mischt man weiches Kupfer und Zinn miteinander, erhält man die sehr harten und zähen Bronzearten. Offenbar verhindern die Fremdatome das Gleiten der Gitterschichten; sie wirken als "atomarer Schmirgelsand".
Legierungen sind von extremer technischer Wichtigkeit, sind aber unter dem Gesichtspunkt des Recyclings oftmals Problemstoffe.