6 Physikalische Eigenschaften der Stoffe
Mit der Benennung von Eigenschaften lassen sich Stoffe beschreiben und unterscheiden. Die Eigenschaften sind in zwei Gruppen zu ordnen.
A. Subjektive Stoffeigenschaften
Einige Eigenschaften hängen vom Eindruck des Beobachters ab:
Subjektive Stoffeigenschaften können sich in der Beurteilung von Person zu Person ändern. Der eine leidet unter dem chlorartigen NOx-Geruch, der andere riecht gar nichts und wundert sich über die Aufregung. Manche riechen kein Blausäure- oder Schwefelwasserstoffgas. Andere kennen keinen Geschmack für Bitter. Daher essen sie solange Bittermandeln oder Pfirsichkerne, bis sich Vergiftungserscheinungen zeigen.
B. Objektive Stoffeigenschaften
Diese kann man messen. Die folgende Übersicht ist eine Auswahl aus den vielen denkbaren Möglichkeiten. In Klammern stehen extreme Vergleichspaare.
Man kann noch viele andere Eigenschaften definieren, die zum Auffinden und zur sicheren Charakterisierung eines Stoffes dienen.
Je nach Methode findet man nur denjenigen Stoff, den man mit den gewählten Verfahren aufspüren kann oder will. Ein Beispiel für diese selektive Wahrnehmung: Die gängigen Pestizide in Oberflächenwasser lassen sich gaschromatographisch mit einer einzigen Säule auftrennen. Je nach Detektortyp erhält man jedoch verschiedene Chromatogramme, die erst in ihrer Gesamtheit einen Eindruck von der Belastung des Wassers geben. Dies macht das Auffinden von Fremdstoffen in den belasteten Medien so schwierig. Vielen kommt man deshalb nur durch Indiskretionen oder durch Zufälle auf die Spur.
Leuchtet man einen 100,- DM-Schein einmal mit VIS-Licht und dann mit UV-Strahlung an, scheint es sich um völlig verschiedene Stücke zu handeln. Hat man keinen UV-Strahler zur Hand, muss man nach anderen objektivierenden Kriterien wie Wasserzeichen, Aluminiumfaden usw. suchen.
6.1 Aggregatzustände
Alle Stoffe treten in mindestens drei Aggregatzuständen auf: Fest - Flüssig - Gasförmig. So gibt es den Stoff H2O als festes Wassereis, flüssiges Wasser und Wasserdampf. Aber auch Gase zeigen diese Zustände: Kohlendioxid (CO2 existiert als Gas, Flüssigkeit oder Eis (sog. Trockeneis).
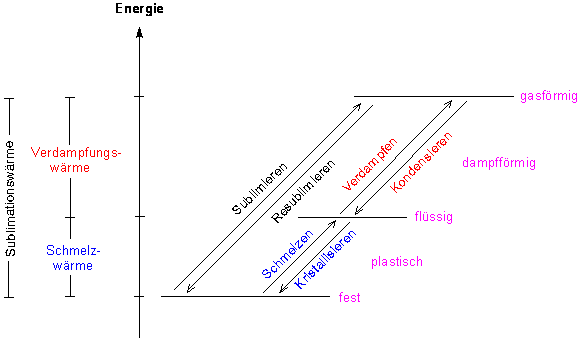
Die Abb. 18 zeigt den Zusammenhang zwischen Aggregatzustand und Energiezufuhr. Im festen Zustand sind die Teilchen hochgeordnet, z. B. in einem Kristallgitter, in der Flüssigkeit ist die Ordnung geringer, die Teilchen hängen aber noch zusammen. In der Gasform bewegen sich alle Teilchen mehr oder weniger unbeeinflusst.

Abb. 18: Aggregatzustände (schematisch)
Jeder Zustandswechsel ist durch ein bestimmtes Wertepaar von
Druck und Temperatur charakterisiert. Da diese Werte extrem
reproduzierbar sind, dienen sie auch zur Eichung von
Thermometern (z. B. Celsius-Skala).
Zwischen den Zuständen Fest und Flüssig befindet sich der plastische Übergangszustand, der nicht durch scharfe Temperaturwerte charakterisiert ist. Dies liegt am uneinheitlichen Aufbau des Festkörpers.
Der direkte Übergang Fest-Gasförmig und umgekehrt, d.h. das Verdunsten von Festkörpern, heißt Sublimation. Es spielt eine wichtige Rolle bei Deodorants (Deostift, Toiletten- und Küchenluftreiniger), Verdunsten von Mottenkugeln (Naphthalin) und anderen Insektengiften, aber auch beim Verdunsten von Eis (Gefriertrocknung; -> 7.1).
Gase lassen sich durch hohen Druck in einen sog. überkritischen Zustand überführen, der dem einer Flüssigkeit ähnelt, aber nur ein hochkomprimiertes Gas ist. Dieser Zustand betrifft vor allem Gase in Gasdruckflaschen. Manche Gase wie das überkritische CO2 oder Distickstoffoxid (N2O) finden Verwendung als Lösemittel, z. B. bei der Extraktion von Cholesterin aus Eigelb.
6.2 Phasen
Im Zusammenhang mit Stoff- und Reaktionsbeschreibungen taucht häufig der Begriff Phase auf.
Phasen sind homogene (d.h. im Aggregatzustand einheitliche) Abschnitte der Materie, die durch Grenzschichten getrennt sind. Dies können Einzelstoffe (ein Stück Gold ist eine Phase) oder Gemische sein: Luft, ein Müllhaufen oder eine Salzlösung sind jeweils eine (Misch-)Phase. Wasser mit Sandgrund ist ein zweiphasiges Gemisch: es besteht aus einer festen Sandphase und einer flüssigen Wasserphase. Ein und derselbe Stoff kann aus einer festen, flüssigen und gasförmigen Phase bestehen: Eis, Wasser und Wasserdampf sind drei Phasen eines einzigen chemischen Stoffs: Wasser H2O. Ein Reinstoff kann somit gleichzeitig drei Phasen bilden.
Zwei nicht oder wenig mischbare Stoffe wie Wasser und CKW bilden zwei Phasen unterschiedlicher Dichte: eine leichtere Wasserphase mit CKW-Anteilen und eine schwerere CKW-Phase mit Wasseranteilen - wichtig für die Ausbildung einer CKW-Fahne unter dem Grundwasser.
Grenzflächenaktive Stoffe (wie Detergentien) reichern sich an den Phasengrenzen an.
6.3 Reinstoffe
Reinstoffe sind stofflich einheitlich wie z. B. Kochsalz (NaCl), Zucker, Quecksilber (Hg) oder reines (destilliertes) Wasser. Sie können einphasig oder mehrphasig sein. Kochsalz ist bei 0 °C einphasig, Wasser dagegen dreiphasig (feste, flüssige und gasförmige Phase).
Reinstoffe herzustellen ist sehr aufwendig und eine zentrale Aufgabe der Chemie, auch der Umweltchemie. Dies betrifft z. B. die Reinigung von Titandioxid zur Gewinnung von wirklich weißem Titanweiß. Die meisten analytischen Verfahren beruhen darauf, dass man aus einem Gemisch Reinstoffe isoliert, um sie anschließend charakterisieren zu können.
6.4 Stoffgemische
Gemische bestehen aus mehreren Reinstoffen. Es gibt zwei für die Umweltchemie wesentliche Arten von Gemischen, die zusätzlich noch nach der Art der beteiligten Phasen unterschieden werden.
Heterogene Gemische
Diese mehrphasigen Systeme besitzen die Eigenschaften der Einzelkomponenten, was für deren Auftrennung wichtig ist. Von Bedeutung ist die Unterscheidung der heterogenen Gemische nach den Aggregatzuständen ihrer Komponenten:
Fest - fest: Gemenge
(z. B. Kompost, Müllhaufen, Holz (aus Lignin und Cellulose), Granit,
Erde, Mensaessen, Vollkornbrot.)
Fest - flüssig: Aufschlämmung, Suspension, kolloidale
Lösung
(z. B. Grundwasser, Lehmwasser, Hühnereiweiß.)
Fest - gasförmig: Aerosol, Schwebstoffe
(z. B. Zigarettenrauch, Saharasand in der Atmosphäre.)
Flüssig - flüssig: Emulsion
(z. B. Milch, Mayonnaise, Schmelzkäse, Cremes.)
Flüssig - gasförmig: Aerosol, gasende Flüssigkeit, Schaum
(z. B. Nebel, Benzin im Vergaser, Champagner, Seifenschaum.)
Homogene Gemische
Beispiele für diese einphasigen Systeme sind:
| - | Lösungen
Kalisalz im Weserwasser, Zucker in Cola, Sauerstoff oder CO2 in Wasser, Ammoniak in der Gülle, Alkohol oder CKW in Wasser, Fett in PER (auch: PER in Fett), Farbstoff im Benzin. |
| - | Gasförmige Gemische:
Luft als Gemisch von O2, N2, CO2, Wasserdampf, Edelgasen oder FCKW. Kraftwerksabgase mit Schadstoffen wie NOx, SO2 und CO2. |
| - | Feste Gemische:
Legierungen bei speziellen Mischungspunkten (Stahl, Bronze, Messing, Lagermetalle), Weichmacher in PVC-Folien, bestimmte Mineralien wie Bauxit. |
6.5 Mischungseffekte in Lösungen und Schmelzen
Löst man einen Stoff in einem Lösungsmittel oder in einer Schmelze, so treten aufgrund der Wechselwirkungen zwischen dem Lösemittel und dem gelösten Stoff bestimmte, für die Umwelt wichtige Effekte auf.
Siedepunktserhöhung, Dampfdruckerniedrigung
Salzwasser siedet bei höherer Temperatur als reines Wasser.
Über salzreichem Meerwasser ist deswegen der Wasserdampfgehalt der
Atmosphäre niedriger als über Süßwasser. Der Grund: Die gelösten
Stoffe halten die Wassermoleküle in der Lösung fest. Daher muss
mehr Energie zugeführt werden, um diese Bindungen zu lösen. Das
Lösemittel verdampft deshalb erst bei höheren Temperaturen.
(Wichtig für Wetterbildung über dem Meer.)
Schmelzpunktserniedrigung (= Gefrierpunktserniedrigung)
Man beobachtet, dass verunreinigte feste Stoffe einen niedrigeren
Schmelzpunkt haben als die Reinstoffe. Der Grund ist, dass die
Verunreinigungen die hohe Ordnung des Kristallgitters des Reinstoffs stören und dieses
deshalb schon bei niedrigerer Temperatur zusammenbricht.
Beispiele:
| - | Mischung von höherschmelzenden Metallen mit dem Ziel der Gewinnung von niedrigschmelzenden Legierungen. Diese spielen bei Sprinkleranlagen oder zur Herstellung von Drucktypen eine gewisse Rolle. |

Tab. 7: Niedrigschmelzende Legierungen
| Wood-Metall (SchmP 70 °C) | Rose-Metall (SchmP 94 °C) |
| 4 Teile Bi (271 °C)
2 Teile Pb (327 °C) 1 Teil Sn (232 °C) 1 Teil Cd (321 °C) |
2 Teile Bi
1 Teil Pb 1 Teil Sn |
| - | Bei der Schmelzelektrolyse von Natriumchlorid senkt man dessen Schmelzpunkt (801 °C) mit Calciumchlorid CaCl2 auf ca. 600 ºC. Gleiches gilt für die Schmelzelektrolyse von Aluminiumoxid (SchmP 2045 °C). Durch Zumischung von Kryolith Na3[AlF6], einem Fluorokomplex des Aluminiums, senkt man den Schmelzpunkt auf 935 °C. Allerdings enthält die Mischung dann 80 % an Kryolith, dessen Schmelzpunkt bei 980 °C liegt. |
| - | Die Schmelzpunktserniedrigung nutzt man beim Zonenschmelzverfahren zur Reinigung von Metallen und anderen Stoffen wie Silicium aus. Hierbei erhitzt man einen Stab aus dem verunreinigten und deshalb niedriger schmelzenden Silicium in einer scharfen Zone bis zum Schmelzen. Man bewegt diese Zone langsam längs des Stabes. Dabei sammeln sich die Verunreinigungen zunehmend in der Schmelze, während beim Abkühlen nur der höher schmelzende Reinstoff auskristallisiert. (Analogie zum Salzwasser!) |

Tab. 8: Kältemischungen
| Stoff | g Stoff/
100 g Eis |
Niedrigste erreichbare
Temperatur in °C |
| NaCl
Ethanol H2SO4 (66 %) CaCl2 · 6 H2O |
33
105 91 143 |
- 21,3
- 30 - 37 - 55 |
| - | Beim Mischen von Kochsalz (und anderen Stoffen) mit Eis stellen sich definierte, tiefe Gleichgewichtstemperaturen ein. Grund ist, da die Lösungswärme für das Salz und die Schmelzwärme für das Eis aus der Umgebung entnommen werden. Dies nutzt man zum Herstellen von Kältemischungen aus (-> Tab. 8). Historisch ist die Mischung von Salpeter und Eis (ca. 30 °C) von Bedeutung, mit deren Hilfe man in früher Zeit auch im Sommer Sahneeis herstellen konnte. Das Wassereis "erntete" man im Winter und bewahrte es unter Stroh in speziellen Eiskellern auf. | - | Salzwasser kann man weit unter 0 °C, den Gefrierpunkt von reinem Wasser, abkühlen. Salziges Meerwasser gefriert deshalb nicht so rasch. Der Grund: Eis, das aus Salzwasser auskristallisiert, ist reines Süßwasser. Die vom gelösten Stoff festgehaltenen Wassermoleküle werden gehindert, ein Eiskristallgitter aufzubauen. Dies gelingt erst bei tieferen Temperaturen, da die dann freiwerdende größere Kristallisationsenergie des Wassers ausreicht, die Lösemittelmoleküle aus ihrer Bindung an Ionen und andere Stoffe zu lösen. |
| - | Den Effekt der Gefrierpunktserniedrigung nutzt man im Winter, um Glatteis zu schmelzen. Hierzu werden Salze (NaCl oder CaCl2) auf das Eis gestreut. Dabei beobachtet man, dass sich festes, scheinbar trockenes Eis verflüssigt. Eis steht in einem dynamischen Gleichgewicht (-> 11) mit flüssigem Wasser: |
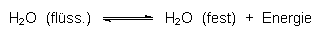
| Gibt man nun Salz hinzu, so löst sich dieses unter gleichzeitiger Abkühlung im flüssigen Wasseranteil. Das dem Gleichgewicht entzogene Wasser wird ständig nachgebildet. Das Gleichgewicht verschiebt sich somit in die linke Richtung; das Eis verflüssigt sich zu einer konzentrierten Salzlösung. Da das NaCl/Eis-Gemisch keine tieferen Temperaturen als – 21,3 °C ermöglicht, nützt unterhalb dieser Temperatur das Streuen von Natriumchlorid nichts mehr. Eine Alternative ist das umweltneutralere Calciumchlorid CaCl2, ein Abfallprodukt der Sodaherstellung, da dessen konzentrierte Lösungen erst ab – 55 °C gefrieren. |
Osmotischer Druck
| - | Hierbei handelt es sich um die Wechselwirkung an einer semipermeablen Membran zwischen reinem Wasser und einer konzentrierten Lösung. Der Konzentrationsausgleich hat eine Verdünnung sowie einen hydrostatischen Druck zur Folge. Dieser Effekt wird in Abschnitt 7.1 beschrieben. |
6.6 Der Systembegriff
Von großer Wichtigkeit ist der Begriff des Systems. Darunter versteht ein Naturwissenschaftler dasjenige Stück Materie, das er (gedanklich) aus dem Universum herausschneidet, um es in aller Ruhe kontrolliert untersuchen zu können. Man variiert meistens Parameter wie Druck, Temperatur und Konzentration der im System enthaltenen Stoffe. Je nach Abtrennung von der Umgebung unterscheidet man folgende Systemarten:
Abgeschlossenes System
Dieses System tauscht (außer Informationen) mit der Umgebung gar nichts aus. In der Natur lässt sich dieses System (etwa eine gut verschlossene Thermosflasche) nicht realisieren, auch nicht auf einer Insel im Pazifik oder auf dem Acker des biologisch orientierten Bauern. Man vermutet, dass das Weltall letztlich ein abgeschlossenes System ist.
Geschlossenes System
Dieses System tauscht mit der Umgebung nur Energie aus, nicht aber Materie. Beispiele sind Reagenzgläser oder Gewächshäuser ("Biosphäre-Projekt"). Hier kann man z. B. kontrolliert untersuchen, wie sich Schadstoffe in der Atmosphäre auf das Pflanzenwachstum auswirken. Die Energie wird durch Sonnenlicht oder Lampen zugeführt.
Adiabates System
Die Zustände dieses Systems werden ausschließlich durch Kompression variiert. Die zugeführte Volumenarbeit wandelt sich in Wärmeenergie um, die im System verbleibt. Dieses System spielt eine wichtige Rolle bei austauscharmen Zuständen (Inversionsschichten), Föhnwetterlage (dünne kalte Luft fällt ins Tal, wird dabei komprimiert und erwärmt sich). Eine andere Anwendung ist der Dieselmotor, dessen Brennstoff-Luftgemisch durch Kompression gezündet wird.
Offenes System
Systeme, die mit der Umgebung Druck, Arbeit, Wärme und Materie austauschen, sind zunächst bei chemischen Durchflussreaktoren oder Brennkammern eines Kraftwerkes realisiert. Man spricht hier von nicht geschlossenen Systemen.
Offene Systeme im eigentlichen Sinne sind die Lebewesen, aber auch die Atmosphäre oder die anderen Sphären der Erdoberfläche. Letztlich ist die ganze Umwelt als offenes System anzusehen.
In offenen Systemen laufen selbstregulatorische Prozesse ab, die so stark verschachtelt und komplex sind, dass man sie insgesamt kaum noch überblicken kann. Dies ist der Grund, weshalb ein Naturwissenschaftler die Parameter reduzieren muss, um Erkenntnisse zu erlangen. Dabei besteht jedoch die Gefahr, dass der Überblick über Zusammenhänge verloren geht - eine Ursache für lineares Denken.
Ähnliche Systemabgrenzungen gibt es auch in den anderen Wissenschaften. Allerdings ist es gefährlich, vereinfachende Parameterdenkansätze auf Modellsysteme wie menschliche Gesellschaft, Geschichte, Rasse oder Wirtschaft zu übertragen. Hier ist lineares Denken überhaupt nicht angezeigt und oft genug zutiefst inhuman.