12 Katalysatoren
12.1 Definitionen
Zur Beschleunigung der Einstellung von chemischen Gleichgewichten kann man Parameter wie Druck und Temperatur verändern, z. B. steigern, oder die Konzentration eines Reaktionspartners stark erhöhen ("im Überschuss zugeben"). Ziel ist verstärkte Aktivierung durch vermehrte Bildung von aktivierten Zwischenverbindungen wie AB*, A* oder B*. Bei zu starker Energiezufuhr werden jedoch Rückreaktionen begünstigt (-> Abb. 22) und Verbindungen radikalisch zerstört. Unregelbare Reaktionen sind die Folge. Damit erhält man aber auch viel Wärmemüll und stofflichen Abfall. Um das zu verhindern, setzt man Katalysatoren ein.
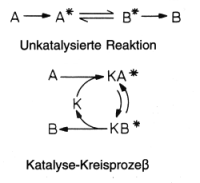
Katalysatoren sind chemische Stoffe, die aufgrund der Bildung von Zwischenverbindungen mit den Reaktanden reaktionsbeschleunigend wirken. Die dazu benötigte Aktivierungsenergie ist wesentlich geringer als bei Reaktionsablauf ohne Katalysator. Der Katalysator liegt nach der Reaktion unverändert vor und kann erneut eingreifen. Damit formuliert man solche Reaktionen am besten als Kreisprozess (-> Abb. 23). Ein quantitatives Beispiel findet man in Abb. 24.

Abb. 23: Reaktion mit Katalysatorkreislauf. Mit dem Stern bezeichnet man aktivierte Moleküle oder aktivierte Edukt- bzw. Produkt/Katalysator-Komplexe
Voraussetzung für die Katalyse ist, dass die Reaktion überhaupt möglich ist. Katalysatoren sorgen für die raschere Einstellung einer Gleichgewichtslage, ohne diese jedoch zu verschieben. So bleibt auch beim Autoabgaskatalysator stets ein Rest von 10 % NOx übrig, der als Gleichgewichtsmenge nicht umgesetzt werden kann.
12.2 Katalytische Spaltung von Wasserstoffperoxid
Zur Verdeutlichung der Katalysatorwirkung soll die Spaltung von Wasserstoffperoxid H2O2 eingehender betrachtet werden:
Normalerweise ist eine verdünnte, ca. 20proz. H2O2-Lösung bei Zimmertemperatur stabil. Gibt man jedoch Kaliumiodidlösung, Platinmetall oder Braunstein (Mangandioxid) hinzu, so entwickelt sich in exothermer Reaktion Sauerstoff. Noch wesentlich effektiver ist Blut, das das gegenüber H2O2 hochspezifische eisenhaltige Enzym Katalase (H2O2: H2O2-Oxidoreduktase) enthält.
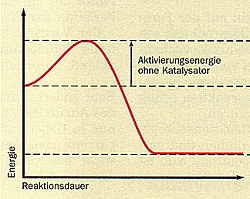
Die folgende Abb. 24 zeigt den Energieumsatz im Verlauf einer chemischen Reaktion. Dabei wird der wichtigste Effekt der Katalyse, der schonende Einsatz an Aktivierungsenergie, besonders deutlich.
 ,
, 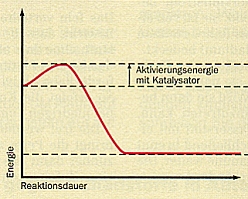
Abb. 24: Energiediagramme von Reaktionen ohne und mit Katalysator
(Quelle: Cornelsen)
Es wurde schon darauf hingewiesen, dass bei ein und derselben
Reaktion verschiedene Stoffe als Katalysator wirken können.
Unterschiede gibt es jedoch in der Wirksamkeit.
| Tab. 10: Katalyse der H2O2-Spaltung bei 25 °C | ||||
| Katalysator | Eakt (kJ/Mol H2O2) | Q10 | Anteil der aktivierten Moleküle (%) | Relative Zunahme der Reaktionsgeschwindigkeit |
| Ohne | 76 | 2,77 | 1,3 · 10¯11 | 1 |
| Iodid | 59 | 2,21 | 1 · 10¯8 | 8 · 102 |
| Platin | 50 | 1,97 | 3 · 10¯7 | 2 · 104 |
| Katalase | 6 | 1,09 | 6 | 3 · 1011 |
Die Tabelle 10 zeigt den Zusammenhang zwischen unkatalysierter und mit verschiedenen Katalysatoren ablaufender Reaktion. Der Q10-Wert gibt an, um welchen Faktor die Geschwindigkeit der jeweiligen Reaktion (katalysiert oder nicht) zunimmt, wenn man die Temperatur um 10 °C steigert. Normalerweise findet man Q10-Werte um 2 - 3. Bei den besonders wirksamen Katalysatoren scheint es aber kaum noch einen zusätzlichen Temperatureffekt zu geben, da der Q10-Wert mit der Wirksamkeit des Katalysators immer geringer wird.
Dies liegt daran, dass die Geschwindigkeit von katalysierten Reaktionen auch bei niederen Temperaturen von vornherein schon so hoch ist, dass eine relative Steigerung kaum noch möglich ist. (Da dies vor allem bei Enzymen der Fall ist, darf man Frischkost auch in der Tiefkühltruhe nicht allzu lange lagern.) Von Interesse sind deshalb die absoluten Umsatzzahlen wie der Anteil der reaktionsfähigen, aktivierten Moleküle oder die Zunahme der Reaktionsgeschwindigkeit.
Zur Verdeutlichung soll in diesem Zusammenhang ein Vergleich aus der Wirtschaft herangezogen werden (-> Tab. 11). Vergleicht man modellhaft die Zehnjahres-Autoproduktion zweier Staaten mit höchst unterschiedlicher Produktivität (etwa die UdSSR und die USA), so ist die relative Zunahme (dem Q10 entsprechend) in der UdSSR wesentlich höher, in den USA dagegen vernachlässigbar klein. Daraus darf man nicht schließen, dass die Wirtschaft der UdSSR erfolgreicher sei als die der USA. (An diesem Selbstbetrug ist der Ostblock gescheitert.) Aufschluss über die wahren Verhältnisse geben erst die Absolutzahlen in Tabelle 11.
| Tab. 11: Schematischer Vergleich der Autoproduktion zweier Staaten unterschiedlicher Produktivität | ||||
| Land | Autoproduktion | Zunahme | ||
| 1950 | 1960 | Relativ (%) | Absolut | |
| A | 50.000 | 125.000 | 150 | 75.000 |
| B | 15.000.000 | 16.050.000 | 7 | 1.050.000 |
12.3 Beispiele für Katalysereaktionen
Die folgende Übersicht gibt einige wichtige Beispiele für Katalyseprozesse und ihre chemischen Abläufe. Man unterscheidet homogene (einphasige) Katalysen und heterogene (mehrphasige) Katalysen.
Homogene Katalysen
findet man in Gasen oder Lösungen. Beispiele sind:
Heterogene Katalysen
laufen an Phasengrenzen ab. Wichtig sind vor allem:
Im Folgenden soll auf einige Wirkmechanismen eingegangen werden:
Säurekatalyse
Der Katalysator polarisiert eine Bindung im Molekül und macht sie
damit bereit für den Angriff durch den Reaktionspartner. Beispiel:
Zur Gewinnung von Estern aus schwachen Carbonsäuren und
Alkoholen setzt man starke Säuren wie die Schwefelsäure oder
saure Ionenaustauscher als Katalysator ein (Ester sind wichtige
Lösemittel):
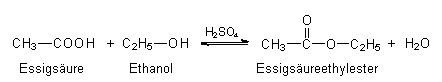
Als eigentliche Katalysatoren wirken die Protonen, die von der Schwefelsäure abgegeben werden (-> Abb. 25). Sie können am Carbonyl-Sauerstoff der Essigsäure angreifen und den Kohlenstoff positiv polarisieren. Hier kann z. B. ein Alkoholmolekül "andocken"; der Ester bildet sich. Andererseits kann auch der Ester polarisiert werden. Dann lagert sich ein Wassermolekül an. Die Folge ist die Spaltung des Esters. Insgesamt bildet sich ein Gleichgewicht aus, dessen Einstellung durch die Protonen beschleunigt wird.
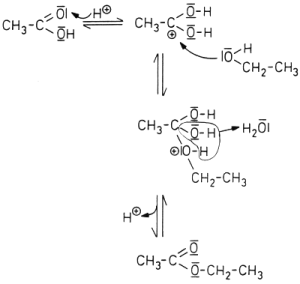
Abb. 25: Reaktionsmechanismus bei der katalysierten Esterbildung
Die Schwefelsäure als Stoff ist genau genommen kein Katalysator,
da sie das Gleichgewicht der Esterbildung
verschiebt. Das geschieht durch Entfernung des Produkts Wasser aus dem Gleichgewicht,
indem sie es bindet. Dadurch wird sie allerdings verdünnt und
nach einer gewissen Zeit unbrauchbar. Dies ist eine wichtige Quelle
für Abfallschwefelsäure (Dünnsäure).
Beim Claus-Prozess (einem wichtigen Entschwefelungsverfahren) dient Wasser als Katalysator, der die Redoxreaktion zwischen gelöstem Schwefelwasserstoff und Schwefeldioxid katalysiert (-> 13.6).
Heterogene Katalyse an Oberflächen
(Kontaktkatalyse)
Durch Wechselwirkung der Elektronen im Metall- oder Oxidkontakt
mit denen des umzusetzenden Stoffs kommt es zur Lockerung oder
Spaltung von Bindungen auch von relativ inerten Verbindungen.
Wasserstoffmoleküle werden durch Platinmetalle (Platin, Rhodium,
Palladium) oder Eisenmetalle (Eisen, Nickel) in hochreaktive
Wasserstoffatome (Radikale) gespalten:
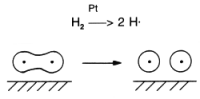
Diese Radikale addieren sich an Doppelbindungen (Fetthärtung) oder reduzieren Schwefelverbindungen zu Schwefelwasserstoff. Ein Beispiel ist die katalytische Druckentschwefelung als Prävention zur SO2-Bildung bei der Verbrennung von Erdgas oder anderen fossilen Brennstoffen:
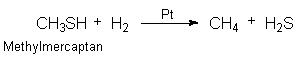
(Methylmercaptan, ein Bestandteil des Stinktiersekrets, wird auch beim Holzaufschluss nach dem Sulfatverfahren emittiert.)
Ein anderes Beispiel ist das Haber-Bosch-Verfahren, bei dem Wasserstoff und Stickstoff an Eisenoberflächen schrittweise zur Reaktion gebracht werden und Ammoniak bilden:
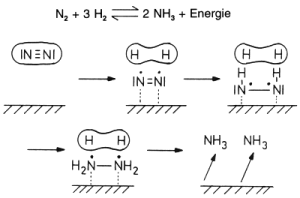
Abb. 26: Vorgänge am Kontakt bei der Ammoniaksynthese
Weitere Beispiele für heterogene Katalysatoren sind
Kontakte aus Edelmetallen und Nichtedelmetalloxiden in Autoabgaskatalysatoren,
die Denoxmasse in Kraftwerksentstickungsanlagen und
oxidische Katalysatoren zur Oxidation von SO2 bei der Schwefelsäuregewinnung.
Hierzu setzt man Metalloxide ein, die wie
Vanadiumoxid leicht ihre Wertigkeit wechseln:
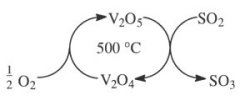
Zur Oxidation von kleineren Mengen SO2 zu Schwefeltrioxid SO3 verwendet man Aktivkohle als Redoxkatalysator (-> 7.3).
Aber auch die Verbrennung von Ammoniak am Platinnetz mit dem Ziel der Gewinnung von Stickoxiden zur Synthese von Salpetersäure ist bedeutsam. Man kann heute sagen, dass es kaum noch technische Prozesse gibt, die ohne Katalysatoren ablaufen. Deren Zusammensetzungen sind teilweise so geheim, dass man die Rezepturen nicht angeben kann.
Enzymkatalysen
Enzyme wirken unter ganz besonders niedrigen Aktivierungsbedingungen, so dass
man hier fast isotherme Reaktionsführung
beobachtet (-> 12.2). Damit ist der Verlust durch Wärmeabgabe
gering, der Gewinn von chemischer Energie (ein Beispiel für wertvolle, sog. "Freie
Energie") optimal.
Enzyme sind aufgrund ihrer Molekülgeometrie auf bestimmte Substrate so angepasst, dass sie im Allgemeinen nur spezifische Reaktionen zwischen spezifischen Stoffen (Substraten) im Sinne eines Schlüssel/Schloss-Verhältnisses zu katalysieren vermögen. Dabei richten sie die Substrate sterisch so aus, dass es zu optimaler Überlappung der Molekülorbitale mit der Folge raschen Elektronenaustausches und Knüpfung neuer Bindungen kommt. Dabei entstehen oftmals Gleichgewichtszustände, von denen aus die Reaktion in die eine oder andere Richtung verläuft, je nachdem, ob das Produkt weiter verbraucht wird oder nicht. Damit werden biochemische Reaktionen leicht steuerbar.
Ein Beispiel ist die Alkoholdehydrogenase, ein Alkohol abbauendes Leberenzym, dessen Mechanismus in Literatur ausführlicher beschrieben wird.
Auch Reaktionen, die sich wie viele biochemische Reaktionen im Reagenzglas nicht nachahmen lassen, laufen in Gegenwart spezifischer Enzyme leicht ab. Ein Beispiel ist die Hydrolyse von Proteinen:
Gibt man Proteine und Wasser zusammen, beobachtet man auch bei langanhaltendem Kochen keine Spaltung. Gibt man dagegen konzentrierte Salzsäure zu und erhitzt unter Druck auf ca. 105 °C, so findet innerhalb einiger Stunden die Hydrolyse statt (Protonenkatalyse). Noch rascher und dabei unter physiologischen Bedingungen wirken eiweißabbauende Verdauungsenzyme wie Pepsin, Trypsin oder Chymotrypsin. Bakterielle Enzyme findet man in Waschmitteln.
Katalyse in Gasphasen
Nicht nur feste oder gelöste Substanzen, sondern auch Gase
können Katalysatoren sein. Bei eingehender Betrachtung stellt man
fest, dass z. B. Stickoxide und letztlich auch OH-Radikale gerade
deshalb in besonders kleinen Konzentrationen wirken, weil sie
Katalysatoren sind. Ein Beispiel hierfür ist die mit der CO-Oxidation
gekoppelte bodennahe Ozonbildung. Hier sind mehrere
Katalysekreisprozesse miteinander verwoben:
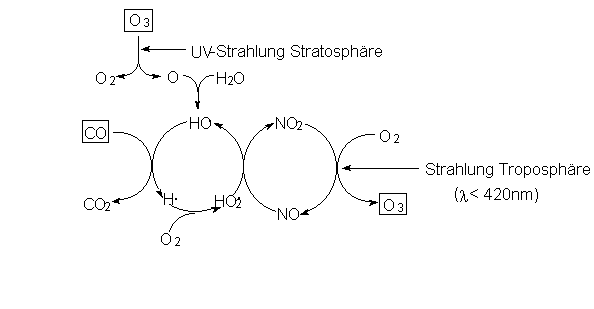
Abb. 27: Ozonbildung in der Troposphäre
Elektrodenoberflächen als Katalysatoren
Weitere Beispiele für Katalysatoren sind auch die Oberflächen von
Elektroden, an denen bei Elektrolysen chemische Reaktionen ablaufen. Platin oder Gold
setzen z. B. die Überspannung herab, die
bei der Wasserelektrolyse u. a. deshalb auftritt, weil sich die
Elektroden mit Gas überziehen. Da diese Metalle Wasserstoff
schwammartig aufsaugen, verringert sich die Aktivierungsenergie
und damit die aufzuwendende Spannung zur Entladung von H+-Ionen. Entgegengesetzt
wirkt Quecksilber beim Amalgamverfahren zur Elektrolyse von wässrigen NaCl-Lösungen,
da es Natriummetall unter Amalgambildung aufnimmt und deshalb eher Natrium-
als Wasserstoff-Ionen entlädt.
Bei Korrosionsprozessen an Kontaktstellen zweier verschiedener Metalle wirkt stets das edlere Metall als Katalysator, indem es Elektronen abzieht und Wasserstoff-Ionen entlädt (-> 13.8.1).
Phasentransferkatalyse
Reaktionen zwischen lipophilen und hydrophilen Phasen erfordern
innige Vermischung. Diese erfolgt im Allgemeinen durch
Erwärmung, die aber die Reaktion umkehren kann. Gibt man dagegen z. B.
Spuren eines Tensids zu, so gelingt es, die Reaktionspartner an der Grenzfläche
reagieren zu lassen.
Vergiftung von Katalysatoren
Feste Katalysatoren und Enzyme benötigen aktive Zentren zur
optimalen Wirkung. Werden diese anderweitig gebunden, so
verringert dies die Aktivität; man spricht von Inhibition oder Vergiftung. So wirken
bei Metall- und Metalloxidkatalysatoren oft Schwefel oder Arsen, bei
Enzymen Schwermetall-Ionen, alkylierende Substanzen wie Lost
oder Esterbildner wie E 605 als Katalysatorengifte.