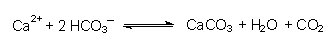14 Säuren, Basen, Salze
Noch heute heißt
Geschmacksproben sind bei der Beurteilung der Eigenschaften von Chemikalien allerdings sehr bedenklich. Deshalb verwendet man Säure/Base-Indikatoren wie Lackmus, Phenolphthalein oder Methylorange. Dies sind Substanzen, die aufgrund der Veränderung ihrer Farben Säuren, neutrale Salzlösungen oder Basen zu unterscheiden vermögen. (Indikatoren gibt es natürlich auch für viele andere Stoffe und Stoffgruppen. Sie finden Verwendung in vielen der sog. Sticks zum Nachweis von umweltrelevanten Chemikalien. Beispiele sind die Redoxindikatoren.)
14.1 pH-Werte und pH-Skala
Die Konzentration der freien Protonen in der Lösung gibt Aufschluss darüber, ob saures oder basisches Milieu vorliegt. Sie wird durch den pH-Wert, den negativen Logarithmus der Protonenkonzentration, beschrieben:
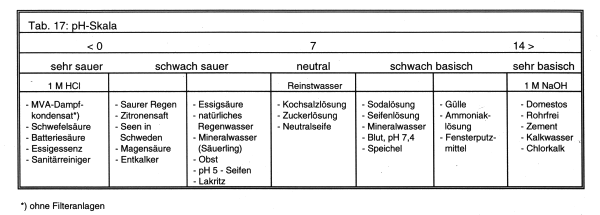
Im natürlichen System liegt dieser Wert im Allgemeinen zwischen 0 und 14, den Werten für jeweils einmolare Lösungen von HCl bzw. NaOH (-> Tab. 17).
Die Schwierigkeit, mit pH-Werten umzugehen, liegt darin, dass die Abnahme des pH-Wertes um eine Einheit jeweils eine Verzehnfachung der Säurekonzentration bedeutet. (Umgekehrtes gilt bei Zunahme um eine pH-Einheit.)
Die Tatsache, dass der pH-Wert schwedischer Seen statt bei 7 bei 3 liegt, bedeutet, dass sie 10.000mal mehr Protonen enthalten als neutrales Wasser bei pH 7.

14.2 Beispiele für Säuren im häuslichen Umfeld
Viele Lebensmittelbestandteile wie Zitronensäure oder andere Fruchtsäuren, Essigsäure (Speiseessig oder Essigessenz), Fettsäuren, Kohlensäure im Pyrmonter Säuerling sind Säuren.
Aber auch viele Haushaltschemikalien sind oder enthalten Säuren. Entkalker beruhen auf der Wirkung von Ameisensäure und Sulfonsäuren. Schwefelsäure ist die leitende Flüssigkeit (Elektrolyt) im Bleiakkumulator. Salzsäure ist in Lötwasser enthalten oder wird immer noch zum Kachelreinigen benutzt. WC-Reiniger bestehen aus sauren Salzen wie Natriumhydrogensulfat.
Säuren wirken ätzend, vor allem, wenn sie höher konzentriert sind. So ist Essigessenz durchaus eine gefährliche Haushaltschemikalie. Stärkere Säuren wie Ameisen-, Schwefel- oder Salzsäure sind Gefahrstoffe, die eigentlich nicht in den Haushalt gehören.
14.3 Beispiele für Basen im häuslichen Umfeld
Wesentlich gefährlicher als Säuren sind jedoch Laugen und Basen. Schon in größter Verdünnung greifen sie Schleimhäute oder die Hornhaut des Auges an. (Seifenschaum brennt in den Augen.) Aber auch hier gibt es graduelle Abstufungen. Beispiele für schwache Laugen sind Mineralwasser auf Sodabasis (Apollinaris), Kernseife und mildere Waschmittel.
Schlimmer sind da schon die folgenden haushaltsüblichen Laugen:
14.4 Säure/Base-Definitionen
Protonen können von einer Säure nur abgegeben werden, wenn eine Base die Protonen übernimmt. Säuren und Basen können folglich nicht isoliert betrachtet werden. (Gleiches gilt für das Elektron bei Redox-Systemen; -> 13.3.) Daher haben sich die Definitionen für Säuren und Basen mit der Zeit geändert. Modern gilt:
Eine Säure/Base-Reaktion ist eine Donator/Akzeptor-Reaktion, die man zunächst als Säure/Base-Gleichgewicht formulieren sollte:
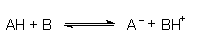
Die protonierte Base ist ihrerseits eine Säure, das Säureanion eine Base geworden. Als Beispiel dienen Palmitinsäure und Natronlauge:
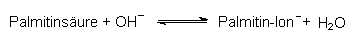
Gibt man umgekehrt Natriumpalmitat (bekannt als Kernseife) in Wasser, so reagiert ein Teil davon als Base, da es von der schwachen Säure Wasser ein Proton übernimmt. Allgemein gilt deshalb für alle Säure/Base-Gleichgewichte:
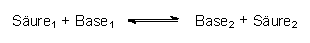
14.5 Säuren
Säuren enthalten alle ein oder mehrere locker gebundene Wasserstoffatome, die in Gegenwart von Wasser als Protonen H+ abgespalten werden können. Man sagt, dass die Säure dissoziiert. Die Protonen werden auf Wasser als Base übertragen. Dabei bilden sich die sog. Oxonium-Ionen H3O+:

Beispiele für umweltrelevante Säuren sind:
| Salzsäure | HCl |
| Flusssäure | HF |
| Salpetersäure | HNO3 |
| Schweflige Säure | H2SO3 |
| Schwefelsäure | H2SO4 |
| Kohlensäure | H2CO3 |
| Phosphorsäure | H3PO4 |
| Blausäure | HCN |
| Ameisensäure | H-COOH |
| Essigsäure | CH3-COOH |
| Phenol | C6H5-OH |
14.5.1 Säurebildung. Säureanhydride
Die meisten Säuren bilden sich durch Reaktionen zwischen Nichtmetalloxiden und Wasser. In diesem Zusammenhang wird daran erinnert, dass z. B. Kohlendioxid gern als Kohlensäure bezeichnet wird. Es ist aber vielmehr ein Säureanhydrid, das erst mit der Base Wasser unter Addition eine Säure (Kohlensäure) bildet:
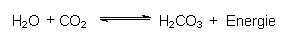

Weitere wichtige Säureanhydride sind:
| - Schwefeldioxid (SO2) | ———> Schweflige Säure | H2SO3, |
| - Schwefeltrioxid (SO3) | ———> Schwefelsäure | H2SO4, |
| - Stickoxide (NOx) | ———> Salpetrige Säure | HNO2, |
| ———> Salpetersäure | HNO3, | |
| - Phosphorpentoxid (P4O10) | ———> Phosphorsäure | H3PO4, |
Andere Säureanhydride wie Chlorwasserstoff HCl oder Fluorwasserstoff HF werden ebenfalls erst im Kontakt mit Wasser (z. B. Regenwasser) zur Salz- oder Flusssäure. Grund ist, dass sie eine Base gefunden haben, die die Protonen aus dem Molekül HCl bzw. HF abspaltet (dissoziiert).
14.5.2 Starke und schwache Säuren
Laien nennen stärker konzentrierte Säure stark, während verdünnte Säuren als schwach bezeichnet werden. In der Chemie versteht man unter dem Begriffspaar stark/schwach etwas anderes. Wenn ein Chemiker eine Säure als schwach bezeichnet, meint er damit nicht ihre Wirkung, sondern dass diese ihr Proton nicht ohne weiteres an die Base Wasser abgibt. So kann eine hochverdünnte ("schwach saure") Säurelösung die starke Salzsäure enthalten. Eine konzentriertere Lösung der schwachen Chloressigsäure wird dagegen als "stark sauer" empfunden. (Sie ist z. B. in Warzentinkturen enthalten.)
Starke Säuren
Starke Säuren liegen in wässriger Lösung vollständig dissoziiert vor. Hier ist das Säure/Base-Gleichgewicht
(-> 14.5) vollständig nach rechts verschoben:
Schwache Säuren
Schwache Säuren wie die Essigsäure liegen nicht vollständig dissoziiert vor. Ihre Reaktion mit der Base stellt ein echtes
Säure/Base-Gleichgewicht dar:
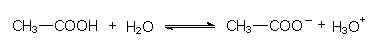
Löst man 0,1 Mol Essigsäure in Wasser, so ist von ihr nur 1/1000 unter Bildung von Acetat-Ionen dissoziiert. Der Rest bleibt als deutlich zu riechende Essigsäure übrig.
Eine schwache Säure ist aber auch das Hydrogensulfat-Ion:
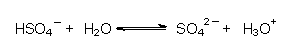
Die Gleichgewichtskonstante wird im Allgemeinen logarithmiert und dann als pK-Wert bezeichnet. Dieser ist der pH-Wert, bei dem 50 % der Säure dissoziiert sind. Je höher er liegt, desto schwächer ist die Säure (-> Tab. 18). Denn dann ist anstelle der Base Wasser die wesentlich stärkere Base OH¯ zur Dissoziation notwendig:
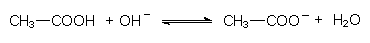
Nun versteht man auch, warum Phenol von seinem Entdecker Runge zunächst Carbolsäure (d. h. der aus Kohlenteer abgetrennte Alkohol, der zugleich eine Säure ist) genannt wurde: Phenollösungen reagieren schwach sauer. Deshalb kann das ansonsten in Wasser schlecht lösliche Phenol mit Natronlauge aus dem Teer extrahiert werden.
Ähnlich schwach sauer ist auch die Blausäure, deren Salze, die in der Galvanotechnik und chemischen Industrie sehr wichtigen Cyanide, leicht darstellbar sind.

| Tab. 18: pK-Werte einiger schwacher Säuren | ||
| Hydronium-Ionen | H3O+/H2O | 1,74 |
| Hydrogensulfat-Ion | HSO4¯ | 1,89 |
| Chloressigsäure | CH2Cl-COOH | 2,81 |
| Ameisensäure | H-COOH | 3,77 |
| Essigsäure | CH3-COOH | 4,76 |
| Schwefelwasserstoff | H2S | 6,99 |
| Ammonium-Ion | NH4+ | 9,25 |
| Blausäure | HCN | 9,40 |
| Phenol | C6H5-OH | 9,90 |
| Hydrogencarbonat | HCO3¯ | 10,40 |
| Wasser | H2O/OH¯ | 15,74 |
Wie alle chemischen Gleichgewichte sind auch Säure/Base-Gleichgewichte konzentrationsabhängig. Hinzufügen von Basen unterstützt die Abtrennung des Protons aus den Säuren. Dies nutzt man bei der Titration aus. Hierbei gibt man solange Laugen wie NaOH zu der Säure, bis alle Protonen abdissoziiert sind. Die überschüssige Lauge reagiert dann mit einem Indikator, der daraufhin seine Farbe ändert.
Gibt man zu schwefliger Säure oder Kohlensäure stärkere Säuren, so vertreibt die starke Säure die schwächere. Dies wird dadurch unterstützt, dass die Säurenanhydride SO2 und CO2 flüchtig sind und deshalb aus dem Gleichgewicht entfernt werden.
Gleiches gilt auch für flüchtige Säuren wie die Essigsäure oder Blausäure. So setzt Schwefelsäure mit Zyankali KCN ("Zyklon B") giftiges Blausäuregas frei. Aber auch starke Säuren, deren Anhydrid flüchtig ist, lassen sich durch konzentrierte Schwefelsäure aus ihren Salzen austreiben. Beispiele sind Salzsäure (aus Kochsalz) oder Salpetersäure (aus Chilesalpeter NaNO3).
14.6 Basen
Basische Stoffe bilden mit Wasser Hydroxid-Ionen. Die wässrigen Lösungen von Basen nennt man auch Laugen.
Natriumhydroxid: NaOH ———> Na+ + OH¯
Calciumoxid: CaO + H2O ———> Ca2+ + 2 OH¯
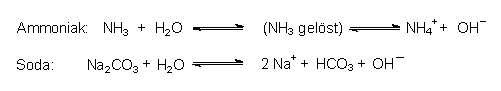
(Ähnliches beobachtet man bei den Salzen langkettiger Fettsäuren, den Seifen; -> 14.4.) Typisch für Basen ist, dass sie H+-Ionen abfangen können; z. B.:
Die eigentliche Base ist hier das OH¯-Ion. Aber auch ungeladene Moleküle wie H2O und NH3 sind Basen:
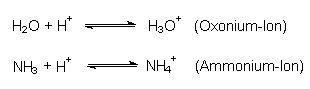
Je mehr Base man zu einer Säure hinzufügt, desto mehr wird von der Säure umgesetzt. Wasser reicht als schwache Base bei höher konzentrierten schwachen Säuren wie der Essigsäure oder nach Schweiß riechende Fettsäuren aber bald nicht mehr aus:
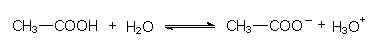
Deshalb muss man zu stärkeren Basen wie Seifen- oder Sodalösung, Ammoniakwasser oder Natronlauge greifen (Waschvorgang). Natronlauge liegt vollständig dissoziiert vor, ist also eine starke Base. Die anderen Basen zeigen ein chemisches Dissoziationsgleichgewicht; sie sind daher schwache Basen.

Wichtige Basen sind:
| Natriumhydroxid | NaOH |
| Kaliumhydroxid | KOH |
| Kalkwasser | Ca(OH)2 |
| Ammoniak | NH3 |
| Amine; z. B. Methylamin | CH3-NH2 |
14.7 Amphotere Stoffe
Manche Stoffe sind zugleich Säure und Base. Diese nennt man Amphotere oder Ampholyte. Die wichtigsten Beispiele sind das Wassersystem sowie dessen Wechselwirkung mit den Aluminium- sowie Eisen-Ionen.
14.7.1 Das Wassersystem
Wasser verhält sich gegenüber Basen wie eine schwache Säure, da es H+-Ionen abgibt:
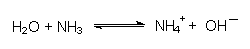
Gegenüber Säuren ist Wasser eine Base, da es auch H+-Ionen aufnimmt:
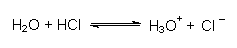
Natürlich gibt es ein Säure/Base-Gleichgewicht, an dem nur Wassermoleküle beteiligt sind:
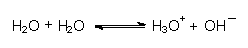
Die Gleichgewichtskonstante nennt man Ionenprodukt des Wassers:
Bei jedem Zustand des Systems, ob sauer oder basisch, ist dieser Wert konstant. Ist z. B. wie in schwedischen Seen die Konzentration der Säure 10¯3 mol l¯1, so findet man in dieser Lösung nur eine OH¯-Konzentration von 10¯11 mol l¯1.
Am Neutralpunkt sind die Konzentrationen von H3O+ und OH¯ gleich:
Hierher kommt die Definition, dass pH 7 der Neutralpunkt des Wassers ist.
14.7.2 Aluminium(III)/Wassersystem. Aprotische Säuren
Aluminium-Ionen entstehen z. B. bei der Einwirkung sauren Regens auf schwerlösliche Bodenmineralien. Sie liegen nicht als nackte Al3+-Ionen vor, sondern als Wasserkomplexe (Aquokomplexe; -> 15).
Tropft man zu einer sauren Aluminiumsalzlösung vorsichtig Natronlauge, so flockt bald das schwerlösliche Aluminiumhydroxid aus. Bei weiterer Zugabe von NaOH löst es sich wieder auf. Gleiches beobachtet man, wenn stattdessen vorsichtig Salzsäure zugetropft wird. Der Grund: Die schwerlöslichen Hydroxyverbindungen von Aluminium sind amphoter. Gegenüber Säuren verhalten sie sich wie Basen und umgekehrt. Daher sind sie in saurem oder basischen Milieu unter Ionenbildung löslich (-> Abb. 33).
Dieses Verhalten kann man durchaus mit dem Wassersystem vergleichen: Das neutrale Aluminiumhydroxid entspricht dem Wasser, der Hexaaquakomplex dem H3O+-Ion und das Aluminat-Ion dem OH¯-Ion.
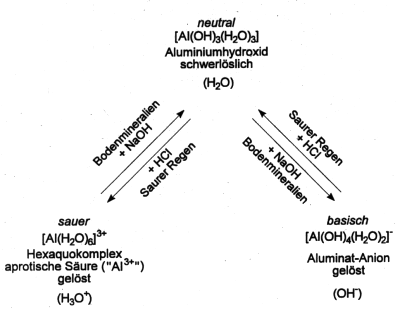
Abb. 33: Aluminium-Ionen/Wassersystem
Das Reaktionsschema der Abb. 33 kann auch wie folgt interpretiert werden: Aluminium-Ionen, die vom sauren Regen freigewaschen
werden, liegen von vornherein als Hexaaquakomplexe vor. Diese können an die neutralere Umgebung selbst Protonen abgeben.
(Lösungen von Aluminiumsalzen wie z. B. Alaun sind immer sauer.) Aluminium-Ionen wirken also bei der Versauerung der Böden
kräftig mit. Man bezeichnet sie übrigens etwas irreführend als aprotische Säuren. Gleiches gilt für Eisen(III)-Salze.
14.8 Weitere Säure/Base-Systeme
14.8.1 Säure/Base-Indikatoren
Säure/Base-Indikatoren sind schwache Säuren oder Basen, deren Anionen bzw. Kationen unterschiedlich farbig sind. Auch für diese kann man Gleichgewichte formulieren:
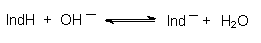
Deren pK-Werte entsprechen annähernd den Umschlagsbereichen des Indikators.
Ein Beispiel ist Paranitrophenol (pK-Wert 7,4), das im neutralen Bereich von Farblos (sauer) nach Tiefgelb (basisch) umschlägt:
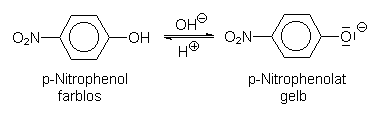
Ein anderes Beispiel ist Methylrot (-> Abb. 34). Dieser Azofarbstoff schlägt von Rot (sauer) im Bereich von pH 4,2 - 6,3 nach Gelb (neutral, basisch) um. Es wird oftmals sauren Entkalkern zugesetzt, um anzuzeigen, wann die Säure verbraucht ist.
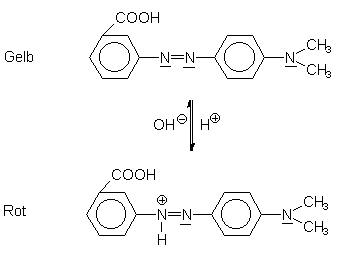
Abb. 34: Methylrot-System
14.8.2 Ionenaustauscher
Auch Ionenaustauscher sind schwache Säure/Base-Systeme. Sie entfernen je nach Ankergruppentyp Kationen oder Anionen aus der Lösung und bilden dabei relativ schwerlösliche Salze. Regeneriert werden sie, indem man sie mit Säuren bzw. Laugen durchspült.
Kationenaustauscher:

Anionenaustauscher:

Schaltet man KAT und AAT hintereinander, so werden alle Kationen und Anionen gegen H+ und OH¯ ausgetauscht, die dann zusammen Wasser bilden (entmineralisiertes Wasser).
Ionenaustauscher spielen eine wichtige Rolle in der Umwelttechnologie, aber auch in der Bodenchemie. So sind Tonmineralien oder Huminsäuren Stoffe mit ausgeprägter Ionenaustauschereigenschaft.
14.9 Neutralisation starker Säuren und starker Basen
Hydroxid-Ionen der Laugen reagieren mit den Protonen der Säuren unter Wasserbildung. Diese exotherme Reaktion nennt man Neutralisation. Hierbei bildet sich neben Wasser ein aus einem Kation und aus einem Anion zusammengesetzter Stoff, ein Salz.
Beispiele sind:
Dabei läuft als chemischer Vorgang nur die eigentliche Neutralisationsreaktion ab:
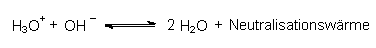
Es handelt sich hier um das Säure/Base-System Wasser. Es ist unabhängig von Art der Kationen oder Anionen, die sich anschließend zum Salz zusammenlagern.
Da überschüssige Säuren oder Laugen vor der Entsorgung neutralisiert werden müssen (etwa HCl in den Abgasen der PVC-Verbrennung durch NaOH), tritt neben der stofflichen Belastung durch die Salzbildung noch die energetische hinzu: Neutralisationswärme ist eine wichtige Prozess- bzw. Abfallwärme.
14.10 Reaktionen schwacher Säuren mit starken Basen
Schwache Säuren reagieren zum allergrößten Teil direkt mit starken Basen, also ohne den Dissoziations-Umweg über das Wassersystem:
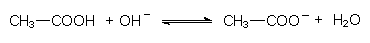
Der Äquivalenzpunkt schwacher Säuren liegt deshalb oberhalb des Neutralpunktes.
Diese Reaktion ist als chemisches Gleichgewicht andersherum formulierbar. Gibt man etwa das Natriumsalz einer schwachen Säure wie Natriumacetat in Wasser, so stellt sich ein basischer pH-Wert ein:
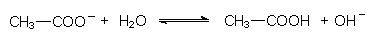
Hiermit ist zugleich die basische Wirkung der Seifen einzuordnen: Seifen sind Natrium- oder Kaliumsalze von langkettigen, schwachen Fettsäuren. Analoges wurde schon von der Soda berichtet.
Die typischen Geruchsstoffe von zersetztem Schweiß sind kurzkettige Carbonsäuren wie z. B. Capron- oder Propionsäure. Schweizer Käse auf frisch getoastetem, noch heißem Weißbrot riecht intensiv nach Buttersäure. Valeriansäure aus Baldrian ist ein bekannter Sexuallockstoff für Katzen. Dabei riechen aber nur die freien Säuren, nicht deren Anionen. Um diese Gerüche zu beseitigen, muss man sie mit Basen (wie Seifenlösung) in die geruchsfreien Anionen überführen.
14.11 Pufferung
Gibt man zu dem Salz einer schwachen Säure wie H2CO3 eine starke Säure, so wird deren Wirkung wegen der Bildung der undissoziierten schwachen Säure vermindert:
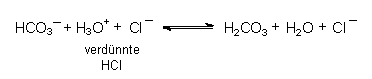
Diesen Mechanismus nennt man Pufferung.
Umgekehrtes gilt für die Abpufferung von Basen durch schwache Säuren:
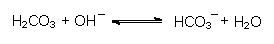
Sodalösung enthält somit als schwache Base auch das Hydrogencarbonat HCO3-Ion, das mit einem Proton zu zunächst undissoziierter Kohlensäure H2CO3 reagieren kann. Kohlensäure zerfällt sofort unter Bildung von H2O und CO2:
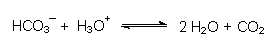
Das Carbonatpuffersystem ist für natürliche Kreisläufe und biochemische Reaktionen sehr wichtig.
Natriumhydrogencarbonat ist als "Bicarbonat" in den milden, die Magensäure abpuffernden Emser Pastillen oder im Kaisernatron enthalten. Magensäure ist eine ca. 0,2 M HCl neben schwächerer, daher puffernder Milchsäure.
Eine Mischung von gleichen Mengen einer schwachen Säure und ihres Salzes ist ein Puffersystem, das optimal gegen kleinere Abweichungen des pH-Wertes nach oben oder unten absichert.
Es gibt eine Reihe von Puffersystemen über den ganzen pH-Bereich hinweg. Deren Wirkung wird durch die Lage des Säure/Base-Gleichgewichts, also durch den pK-Wert charakterisiert.
Pufferung ist für die Existenz von Lebewesen, die interne pH-Änderungen vermeiden müssen, notwendig. Im Blut puffern vor allem Bicarbonat und Hämoglobin, daneben andere Proteine, Aminosäuren sowie Phosphate und Fettsäuren. Der pH-Wert des Blutes schwankt kaum um 0,1 um den Soll-Wert 7,38. Abweichungen nach oben oder unten können schwere Erkrankungen auslösen. Auch Bodenmineralien sind gute Puffersubstanzen.
Wichtig ist es zu wissen, dass Puffer nur eine begrenzte Kapazität haben. So beträgt die Konzentration des Blutpuffers nur 48 mmol l¯1. Mutet man den Böden zuviel sauren Regen zu, so versauern sie nach einiger Zeit.
(Pufferung gibt es auch bei Redoxsystemen. Bekannte Redoxpuffer sind Ascorbinsäure/Dehydroascorbinsäure, NADH/NAD+ oder das Eisen(II)/Eisen(III)-System (-> Tab. 16; 13.7.2).)
14.12 Salze
14.12.1 Aufbau der Salze
Salze sind ionisch aufgebaute, im Allgemeinen kristalline Festkörper. Sie bestehen aus positiv geladenen Kationen und negativ geladenen Anionen. Hierzu zählt man auch die Metalloxide und Metallhydroxide.

| Beispiele für Salze sind: | Formel | Ionen | |
| Natriumchlorid (Kochsalz)
| |||
| Silberbromid (Bromsilber) | AgBr | Ag+ | Br¯ |
| Kaliumnitrat | KNO3 | K+ | NO3¯ |
| Quecksilbersulfid (Zinnober) | HgS | Hg2+ | S2¯ |
| Kupfersulfat | CuSO4 | Cu2+ | SOsub>42¯ |
| Aluminiumoxid (Tonerde) | Al2O3 | 2 Al3+ | 3 O2¯ |
| Ammoniumchlorid (Salmiaksalz) | NH4Cl | NH4+ | Cl¯ |
| Fluoropatit (Zahnschmelz) | Ca2(F,PO4) | 2 Ca2+ | F ¯,PO43¯ |
| Calciumhydroxid (Kalkwasser) | Ca(OH)2 | Ca2+ | 2 OH¯ |
| Calciumcarbonat (Kalkstein) | CaCO3 | Ca2+ | CO32¯ |
Die Anionen können aber auch Metallatome enthalten, während Kationen auch metallfrei sein können:
| Kaliumpermanganat | KMnO4 | K+ | MnO4¯ |
| Ammoniumdichromat | (NH)4)2Cr2O7 | 2 NH4+ | Cr2O72¯ |
14.12.2 Salzbildung
Salze bilden sich durch verschiedenste Reaktionen, die allesamt von großer Bedeutung sind:
- Neutralisationsreaktion und anschließendes Auskristallisieren:
(Reinigung von PVC-Verbrennungsabgasen)
- Addition von Säureanhydriden an Basen:
(Nasse Rauchgasentschwefelung)
- Addition von Säureanhydriden an Metalloxide:
CaO + SO2 ————> CaSO3
(Verschlacken, Trockene Rauchgasentschwefelung)
- Reaktion zwischen Metall und Säure:
Zn + 2 NH4+ ————> Zn2+ + H2 + 2 NH3 + Energie
(Korrosion, Batteriebetrieb)
- Reaktion zwischen Metall und Nichtmetall:
2 Fe + O2 ————> 2 FeO + Energie
(Eisenverlust beim Schmieden bzw. Sauerstoffmangel am Hochofen)
- Austausch der Anionen:
(Veraltete Methode zur Herstellung von Natronlauge aus Kalkwasser und Soda)
- Einwirkung von Säuren auf Metalloxide:
(Aufschluss von Titanerzen durch Schwefelsäure)
- Säure/Base-Reaktion ohne Wasserbeteiligung:
2 NH3 + H2SO4 ————> (NH4)2SO4 + Energie
(Herstellung von Kunstdünger)
14.12.3 Löslichkeit von Salzen. Löslichkeitsprodukt
Viele Salze sind sehr leicht löslich. Dazu gehören vor allem die Nitrate, Ammoniumverbindungen und Chloride. Dies sind besonders umweltrelevante Verbindungen, da sie leicht ins Grundwasser gelangen.
Andere Salze wie die meisten Silicate und Carbonate sind schwerlöslich. Sie sind deswegen Gesteins- und Bodenbildner. Schwerlösliche Salze wie die Sulfide der Schwermetalle, aber auch das Chlorid und Sulfat von Blei häufen sich in Ufersedimenten oder in Organen wie Niere, Knochensubstanz oder Zähnen an (Summationsgifte).
Für schwerlösliche Salze lässt sich ein chemisches Gleichgewicht formulieren; z. B.:
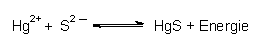
Die Gleichgewichtskonstante nennt man Löslichkeitsprodukt. Es ist das Produkt der Konzentrationen der beteiligten Ionen:
LCa(OH)2 = [Ca2+] · [OH¯]2
Das Löslichkeitsprodukt ist ein Maß für die Löslichkeit eines Salzes. Je kleiner es ist, desto schwerer löslich ist der Stoff. So ist das Löslichkeitsprodukt des extrem schwerlöslichen Quecksilbersulfids HgS nur 10¯54, das von Bleisulfat PbSO4 dagegen nur 10¯8. Der Wert von L hängt noch besonders von der Temperatur ab. Erhitzt man eine Salzlösung mit Bodensatz (gesättigte Lösung), so löst sich dieser auf. Kühlt man diese Lösung wieder ab, so bildet sich der Bodensatz zurück.
Dass sich dagegen beim Kochen von hartem Wasser ein Rückstand von Kalk bildet, liegt einerseits daran, dass Wasser verdampft, die Lösung damit konzentrierter wird und das Löslichkeitsprodukt überschritten wird. Der andere Grund ist, dass das Bicarbonat-Gleichgewicht durch Austreiben von CO2 nach rechts verschoben wird und schwerlöslicher Kalkstein ausfällt: