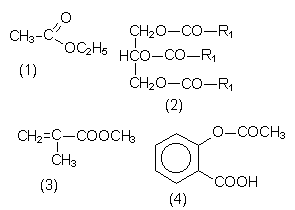
| Ester | Bemerkungen |
| R-COO-R' | Die Gruppe heißt Esterbindung. |
| Essigsäure- ethylester (1) |
Andere Bezeichnung Essigester. Lacklösemittel. Klebstoffverdünner (Geruch nach UHU). |
| Fette, fette Öle (2) | Triglyceride. Glycerinester von Fettsäuren. |
| Methacrylsäure- methylester (3) |
Monomeres von Plexiglas (PMMA). |
| Salicylsäure- essigsäureester (4) |
Bekannt unter dem Namen Aspirin. |

Stickstoffhaltige Derivate
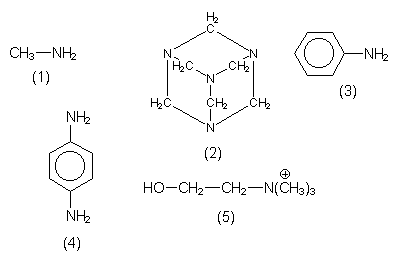
| Amine | Bemerkungen |
| Methylamin (1) | Geruch nach Fisch. Auch in Gülle enthalten. |
| Hexamethylen- tetramin (2) |
Urotropin. Konservierungsmittel für Meeresfrüchte, Desinfektionsmittel, Edukt zur Sprengstoffherstellung. |
| Anilin (3) | Phenylamin. Cancerogen. Wichtige Farbstoffkomponente. Früher aus Steinkohlenteer gewonnen. Buchstabe A im Namen BASF. |
| p-Phenylen- diamin (4) |
Toxische Farbstoffkomponente. Farbfotoentwickler. |
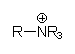 |
Quartäres Amin. Ankergruppe für Anionenaustauscher. |
| Cholin (5) | Quartärer Aminoalkohol, verestert im Acetylcholin (Vagustransmitter) und im Lecithin. |
| Säureamide | Bemerkungen |
| R-CONH2; substituiert: R-CO-NHR' | |
| Glutamin (1) | Aminosäure. |
| Kohlensäure-
amid (2) |
Carbamidsäure. Ihre Ester sind Bestandteil von Polyurethanen. |
| Kohlensäure-
diamid (3) |
Harnstoff. Biogenes Produkt der Stickstoffausscheidung. Technische Herstellung aus Phosgen. Düngersubstanz (z. B. in Hakaphos). Schwefelanaloges ist zusammen mit Harnstoff wichtige Trennsubstanz der Petrochemie. |
| Dimethyl-
formamid (4) |
DMF. Wichtiges, mindergiftiges Lösemittel. |
 |
Cyclisches Amid. Monomeres von Perlon. |
| Polyamid, Peptid (6) | Polymere substituierte Säureamide. |
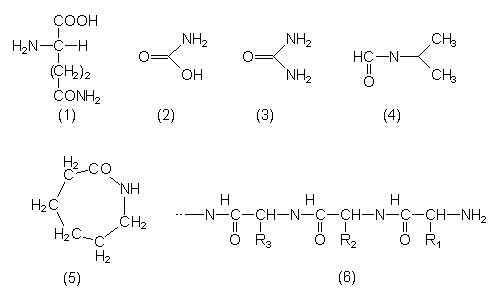
| Nitroverbindungen | Bemerkungen |
| R-NO2 | |
| Nitrobenzol (1) | Grundstoff für Farbstoffe. Mandelgeruch. |
| TNT (2) | Trinitrotoluol. Sprengstoff. |
| Hexogen (3) | Hochbrisanzsprengstoff. Wird durch Behandlung von Urotropin mit HNO3 gewonnen. |
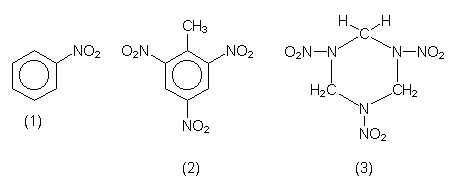
| Salpetersäureester | |
| R-O-NO2 | (Namen enthalten oft fälschlich die Vorsilbe Nitro.) |
| Nitrocellulose (1) | Schießbaumwolle. Als Kunststoff: Celluloid. |
| Nitroglycerin (2) | Sprengöl. Mit Kieselgur: Dynamit. Kreislaufmedikament. |
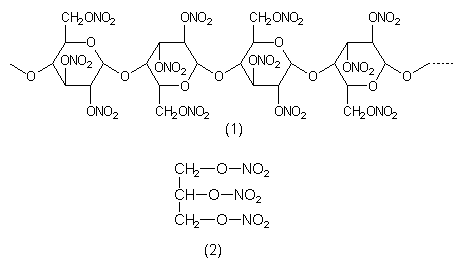
| Nitrile | Bemerkungen |
| R-CN | |
| Alle Nitrile sind wie die analoge Blausäure HCN giftig. | |
| Acetonitril (1) | Giftiges Lösemittel. |
| Acrylnitril (2) | Toxischer Grundstoff für Polyacrylnitril. Sekundenkleber. |
| Amygdalin (3) | Inhaltsstoff von Bittermandeln. Setzt beim Erhitzen Benzaldehyd und Blausäure frei. |
N-N-Verbindungen
| Azoverbindungen | Bemerkungen |
| R-N=N-R' | |
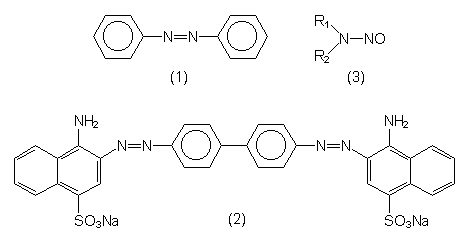
| Azobenzol (1) | Grundstoff der Medikamenten- und Farbenindustrie. Hergestellt aus Anilin oder Nitrobenzol. |
| Kongorot (2) | Typischer, hochkomplizierter Azofarbstoff. |
| Nitrosoverbindungen | |
| Nitrosamine (3) | Cancerogene Verbindungen, entstehen beim Erhitzen von Lebensmitteln. |
Halogenhaltige Derivate
| Halogenierte
Kohlenwasserstoffe |
Bemerkungen | ||
| R-Cl, R-X | |||
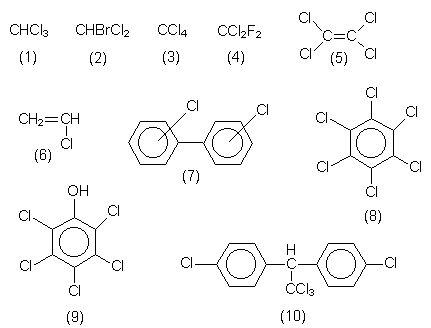
| Chloroform (1) | Betäubendes Lösemittel. | ||
| Gemischte Haloforme (2) | Cancerogen. Entstehen beim Chloren von Schwimmbädern oder von huminsäurehaltigem Abwasser. | ||
| Tetrachlor
methan (3) |
Tetra. Cancerogenes Lösemittel. | ||
| F-12 (4) | Dichlordifluormethan. Typischer
Fluorchlorkohlenwasserstoff (FCKW).
|
||
| Perchlor-
ethylen (5) |
Als Per in chemischen Reinigungen. | ||
| Vinylchlorid (6) | Monomeres von PVC. | ||
| Polychlorierte
Biphenyle (7) |
PCB. Schmier- und Kühlflüssigkeit. Enthalten oder bilden beim Erhitzen leicht Dioxine. | ||
| Hexachlor-
benzol (8) |
HCB. Indikator für Dioxingehalt. | ||
| Pentachlor-
phenol (9) |
PCP. Enthalten in Holzschutzmitteln. | ||
| Dichlordiphenyl-
trichlorethan (10) |
DDT. |
| Säurechloride | Bemerkungen |
| R-COCl | |
| Terephthalsäure-
dichlorid (1) |
Komponente von Polyestern sowie von Kevlar. |
| Adipinsäure-
dichlorid (2) |
Komponente von Nylon. |
| Phosgen (3) | Kohlensäuredichlorid. Wichtige Grundchemikalie. Komponente von Polycarbonaten. |
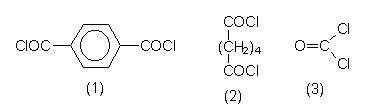
Schwefelhaltige Derivate
| Thioalkohole
(Mercaptane) |
Bemerkungen |
| R-SH | |
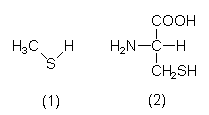
| Methylsulfid (1) | Geruchstoff im Stinktiersekret. Entsteht auch bei Zersetzung biologischen Materials. |
| Cystein (2) | Aminosäure. Antidot bei Schwermetallvergiftung und zur Bodensanierung. ACC = N-Acetyl-Cystein (Schleimlöser). |
| Thioether | |
| R-S-R | |
| Schwefellost (1) | Kampfstoff (Senfgas oder Lost). |
| Thiophen (2) | Wichtiger Schwefelträger im Erdöl. |
| Tetrahydro-
thiophen (3) |
Warngeruchsstoff im Erdgas. |
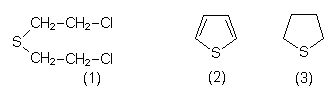
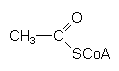
| Thioester | Bemerkungen |
| R-CO-S-R' | |
| Acetyl-CoA | Aktivierte Essigsäure. Schlüsselsubstanz im Stoffwechsel. |
Schwefelsäurederivate
| a) Alkylsulfate | Bemerkungen |
| R-O-SO3Na | |
| Dodecylsulfat | Ester der Schwefelsäure. Als Natriumsalz (SDS) in Feinwaschmitteln. |
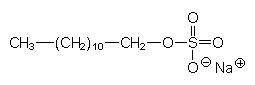
| b) Sulfonsäuren | |
| R-SO3H | Enthalten in Entkalkern. Ankergruppe für Kationenaustauscher. |
Phosphorhaltige Derivate
| Phosphorsäure-
ester |
Bemerkungen |
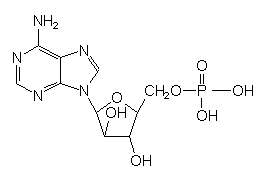
| Adenosinmono-
phosphat AMP |
Nucleotid. Bausteine der Nucleinsäuren. |
| E 605 |
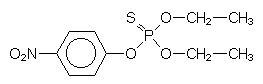
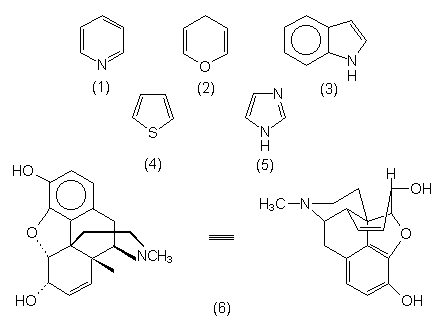
Heterocyclen
Hierunter versteht man cyclische Verbindungen, deren Ringgerüste neben Kohlenstoff Fremdatome wie Stickstoff, Sauerstoff, Schwefel, Bor etc. enthalten. Einige Beispiele sind:
| - Pyridin (1) | Lösemittel. |
| - Pyran (2) | Lösemittel. Grundgerüst der Hexosen. |
| - Indol (3) | Grundbaustein der Aminosäure Tryptophan, von Gewebshormonen (Serotonin), LSD und von Indigo. |
| - Thiophen (4) | Enthalten in S-reichem Erdöl. |
| - Imidazol (5) | Baustein der Aminosäure Histidin und Histamin (Bienengift). |
| - Morphinbase (6) | Morphium. Grundstoff für Codein und Heroin. |
Heterocyclen sind vor allem für die Naturstoff-, Farben-, Medikamenten- sowie Pestizid- und Biochemie von größter Bedeutung. Beispiele für N-Heterocyclen sind Indigo, die Basen der Nucleinsäuren sowie viele Gewebshormone (Serotonin und Histamin). Rauschgifte (Morphium und Lysergsäure) und der Blutfarbstoff Hämoglobin gehören ebenfalls zu dieser Stoffklasse. O-Heterocyclen sind z. B. alle Kohlenhydrate. Blütenfarbstoffe wie die Anthocyane oder Flavone, das Lösemittel Dioxan, die Aflatoxine oder die Dioxine oder Dibenzofurane. Ein S-Heterocyclus ist z. B. das im Erdöl enthaltene Thiophen. Besonders in Fungiziden sind N/S-Heterocyclen zu finden.
Verbindungen mit mehreren verschiedenen funktionellen Gruppen
Aminosäuren
Sie enthalten in ihrer Grundstruktur eine Carboxyl- und eine Aminogruppe. Die Reste weisen dagegen alle denkbaren funktionellen Gruppen auf. Beispiele sind:
- Glycin (1),
- Alanin (2),
- Phenylalanin (3),
- Histidin (4).
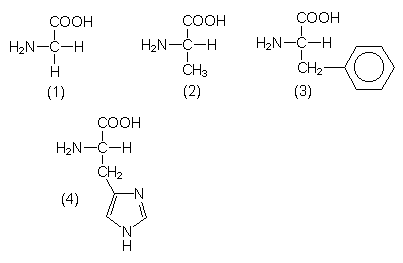
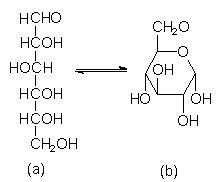
Kohlenhydrate
Kohlenhydrate sind zugleich Carbonylverbindungen und Alkohole (a), die reversibel einen heterocyclischen Ring (b) bilden. Beispiel:
- Glucose.
Hydroxycarbonsäuren
- Milchsäure ist die 2-Hydroxypropansäure (1),
- Ricinolsäure ist die 12-Hydroxyölsäure (2),
- PHB ist die Parahydroxybenzoesäure (3),
- Citronensäure (4).
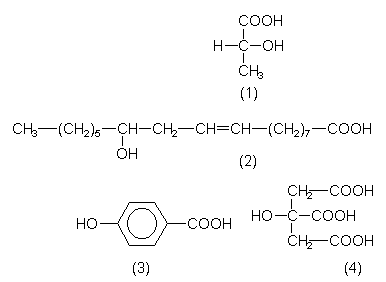
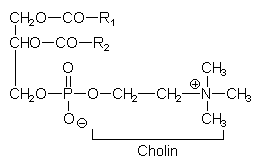
Lecithine
Gruppe von stark polaren Estern des Glycerins mit 2 klassischen Fettsäuren und Phosphorsäure, die wiederum mit Trimethylaminoethanol Cholin verestert ist.
16.3 Reaktionstypen der organischen Chemie
Die Grundreaktionen organischer Verbindungen sind:
- Fragmentierung,
- Eliminierung,
- Addition,
- Substitution,
- Umlagerung.
Ändert sich die Oxidationszahl des Kohlenstoffs, sind die Reaktionen mit Reduktion oder Oxidation verbunden.
Fragmentierung
Diese Reaktion ist für die Umweltchemie besonders wichtig. Darunter versteht man das Zerbrechen von C-C-Bindungen. Dies führt zum Abbau des Moleküls und oft zu ungesättigten Verbindungen oder sogar Ruß (Photosmog). Auslöser sind hochenergetische Strahlung (UV-, Röntgen- oder radioaktive Strahlung) und starke Hitze (Pyrolyse, Verbrennungsmotor). Dabei bilden sich besonders leicht Radikale. Aber auch Pilze und Bakterien sind erfolgreich beim Abbau von Kohlenstoffketten (Kompostierung). Pilze sind besondere Spezialisten zur Öffnung von Benzolringen, wie sie im Lignin vorkommen (Holzabbau). Weitere Beispiele:
- Cracken von langkettigen Erdölbestandteilen:
Dabei entstehen besonders Ethen und Propylen, aber auch Wasserstoff.
- Decarboxylierung von Carbonsäuren:

Eliminierung
Spaltet man von einem größeren Molekül ein kleineres ab, ohne das Kohlenstoffgerüst anzugreifen, spricht man von Eliminierung. Dabei bildet sich stets eine Doppelbindung. Beispiele:
- Gewinnung von Ethen aus Ethanol:
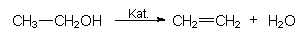
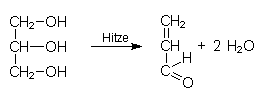
- Bildung von Acrolein aus Glycerin:
- Bildung von Schwefelwasserstoff bei Verwesungsprozessen:
Addition
Dies ist die gegenteilige Reaktion zur Eliminierung. Hierbei addiert man Moleküle an Doppelbindungen. Beispiele sind die Hydrierung von ungesättigten Fetten oder die Vinylierung von Ethin, z. B. durch Addition von HCl unter Bildung von Vinylchlorid. Selbstaddition von einer größeren Zahl von ungesättigten Verbindungen führt zur Polymerisation (Polyaddition). Beispiele:
- Härtung einer ungesättigten Fettsäure:
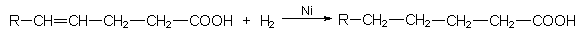
- Bildung von Vinylchlorid durch Addition von HCl an Ethin:
Substitution
Hierbei ersetzt man einen Molekülteil durch einen anderen. Ein Beispiel ist der Abbau von CKW durch Austausch des Halogens gegen eine OH-Gruppe. Werden größere Moleküle unter Abgabe eines kleineren wie H2O oder HCl gebildet, spricht man auch von Kondensation. Wiederholt sich diese Reaktion unter Aufbau von Polymeren, so spricht man von Polykondensation. Beispiele:
- Hydroxylierung von Methylchlorid durch OH-Radikale:
Dies ist eine wichtige Abbaureaktion von CKW in der Atmosphäre.
- Esterbildung (Kondensation):
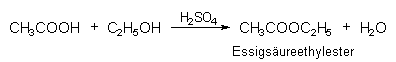
- Alkylierung von Benzol (Friedel-Crafts-Reaktion):
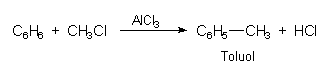
So wird cancerogenes Benzol in weniger bedenkliches Toluol umgewandelt. Dieses vermag in manchen Bereichen Benzol zu ersetzen.
Umlagerung
Hierbei kommt es zu Umgruppierungen innerhalb eines Moleküls. Ein Beispiel ist die Herstellung von Alkohol aus Ethin ("Carbidsprit"). Die dreistufige Reaktion umfasst zwei Grundtypen:
1. Addition von Wasser an Ethin (Quecksilberkatalyse):
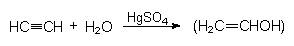
2. Umlagerung des instabilen Vinylalkohols zu Acetaldehyd:
3. Addition von Wasserstoff zur Reduktion des Aldehyds zu Ethanol:
Diese Reaktion wurde in Japan in einem Chemiewerk an der Minamatabucht durchgeführt. Deren quecksilberhaltige Abwässer vergifteten das Meerwasser.
Umlagerungen sind technisch und biochemisch sehr wichtig.