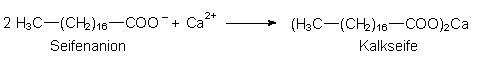
4.5 Enthärter, Komplexbildner
Zur Thematik "Wasserhärte" gibt es eine eigene Webseite der DC2.
Enthärter:
Enthärter haben die Aufgabe, die härtebildenden Ionen (Ca2+- und
Mg2+-Ionen) aus dem Wasser oder auch aus Schmutz zu
entfernen. Die größte Bedeutung hat mengenmäßig die Entfernung
von Calcium-Ionen.
Komplexbildner:
Komplexbildner entfernen ebenfalls Ionen aus Wasser oder
Schmutz. Je nach Art des Komplexbildners werden aber nicht nur
härtebildende Ionen, sondern auch andere Metall-Ionen chemisch
gebunden (-> 4.5.2 und 4.16).
Definition der Wasserhärte:
1 °dH = 0,18 mmol/l Erdalkalien. Das sind 7,1 mg Ca2+- oder 4,3
mg Mg2+-Ionen pro Liter Wasser.
Die folgende Tabelle gibt einen Überblick über Wasserhärtebereiche (-> Tab. 14).
| Tab. 4: Wasserhärtebereiche | ||
| Härtebereiche | Wassereigenschaft | °dH |
| 1 | Weiches Wasser | 0 - 7 |
| 2 | Mittelhartes Wasser | 8 - 14 |
| 3 | Hartes Wasser | 15 - 21 |
| 4 | Sehr hartes Wasser | > 21 |
4.5.1 Bedeutung von Metall-Ionen für den Waschvorgang
Wirkung von hartem Wasser auf Tenside:
Die meisten Tenside werden in ihrer oberflächenaktiven
Eigenschaft durch die härtebildenden Ionen beeinträchtigt:
Seife wird durch Calcium-Ionen in Form der schwer löslichen Kalkseife ausgefällt:
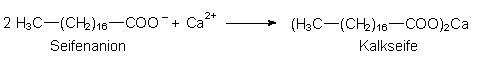
Kalkseife hat keine Tensideigenschaften mehr. Um die gleiche Waschleistung wie in weichem Wasser zu erzielen, muss die gefällte Seife durch weitere Seifenzugabe ersetzt werden. Darüber hinaus wird ein Teil der Seife auch noch benötigt, um die entstandene Kalkseife in der Waschlauge zu dispergieren.
Es gibt zwar Tenside, deren Waschleistung weitgehend härteunabhängig ist, aber die meisten Tenside werden durch Calcium- oder Magnesium-Ionen in ihrer Wirkung deutlich beeinträchtigt.
So nimmt die Waschleistung des meist verwendeten Standardtensides LAS (lineares Alkylbenzolsulfonat) bei einer Erhöhung der Wasserhärte von 0 auf 32 °dH um etwa 30% ab.
Wirkung von Metall-Ionen im Schmutz:
Metall-Ionen verbessern die Haftung von Schmutz an Oberflächen
und erhöhen den Zusammenhalt von Schmutzpartikeln. Positive
Metall-Ionen können als "Vermittler" zwischen negativ polarisierten
Oberflächen und negativ polarisierten Schmutzbestandteilen
dienen. Im Schmutz können Metall-Ionen als
Zentralatom komplexartig gebunden werden. Dies erschwert die
für die Reinigung wichtige Quellung von proteinhaltigem Schmutz,
weil die negativ polarisierten Molekülgruppen des Proteins durch
die Bindung an das Metall-Ion nicht für eine Wechselwirkung mit
Wasser verfügbar sind.
Verschmutzungen sind deshalb besser entfernbar, wenn ihnen die Metall-Ionen entzogen werden.
Bildung von Gips- und Kalkablagerungen:
Calcium-Ionen bilden mit Sulfat-Ionen schwerlöslichen Gips:
Bei über 60 °C Wassertemperatur bildet sich aus wasserlöslichem Calciumhydrogencarbonat schwerlösliches Calciumcarbonat (Kalk):
Gips und Kalk können sich auf dem Reinigungsgut ablagern. Kalk bildet sich besonders leicht an den Heizstäben von Waschmaschinen, weil hier die Temperatur am höchsten ist. Die Kalkkruste auf den Heizstäben wirkt als Wärmeisolator. Dadurch wird der Energieverbrauch zum Aufheizen der Waschlauge unnötig vergrößert und die Heizstäbe können durchbrennen.
Zerfall von Bleichmitteln:
Schwermetall-Ionen katalysieren den Zerfall von Bleichmitteln, so
dass deren Wirkung bereits vor dem eigentlichen Waschvorgang
verloren geht. Komplexbildner können die im Waschmittel als
Verunreinigung vorhandenen Schwermetall-Ionen binden
(komplexieren), so dass die Bleichmittel prophylaktisch stabilisiert
werden (vgl. 4.16).
4.5.2 Wirkungsweise von Enthärtern und
Komplexbildnern
Durch die Entfernung von Metall-Ionen aus der Waschflotte und dem Schmutz werden folgende Wirkungen erreicht:
Die dispergierende Wirkung von bestimmten Enthärtern (Natriumtriphosphat) beruht weniger auf dem Entzug der Metall-Ionen aus Schmutz als auf der Adsorption negativ geladener Triphosphat-Ionen an Schmutzpartikel. Dadurch wird der Schmutz negativ aufgeladen. Die gleichnamig geladenen Schmutzpartikel zerfallen leicht in noch kleinere Bestandteile und stoßen sich außerdem gegenseitig ab. Auch von negativ geladenen oder polarisierten Oberflächen wird der Schmutz abgestoßen.
Bei der Entfernung von Metall-Ionen aus der Waschflotte können grundsätzlich drei Wirkungsmechanismen unterschieden werden:
Im folgenden werden die wichtigsten Substanzen unter den Aspekten Wirkungsweise und Umweltbedeutung besprochen:
Natriumtriphosphat:
Natriumtriphosphat (vgl. 4.1) wirkt komplexierend. Sein Vorteil ist
die schnelle Bindung von Calcium-Ionen, die den Hauptteil der
Wasserhärte ausmachen. Natriumtriphosphat hat gleichzeitig
dispergierende Eigenschaften und unterstützt damit den
Reinigungsvorgang. Außerdem ist es ungiftig. Der wesentliche
Nachteil dieser Verbindung ist der Düngereffekt, der zur
Eutrophierung (-> s. u.) von Oberflächengewässern führt. Aus
diesem Grund ist es notwendig, die Abwasserbelastung mit
Natriumtriphosphat, das vor allem in Waschmitteln und
Maschinen-Geschirrspülmitteln enthalten ist, weitgehend zu
reduzieren.
Eutrophierung:
Das Wachstum von Pflanzen ist vor allem durch das begrenzte
Angebot bestimmter phosphor- oder stickstoffhaltiger Nährstoffe
limitiert. Gelangen diese Nährstoffe, die in Wasch- und Reinigungsmitteln
enthalten sind über das Abwasser in Oberflächengewässer,
so tritt hier eine starke Vermehrung von Algen ein.
Aus Lichtmangel stirbt ein großer Teil der Algen ab und sinkt zu Boden. Am Boden ist für den Abbau von so großen Mengen toter Pflanzen nicht genügend Sauerstoff vorhanden, so dass eine faulende Schlammschicht entsteht. Die freigesetzten Faulgase (Ammoniak, Schwefelwasserstoff) sind giftig und führen zum Absterben von Fischen und anderen Wasserlebewesen. Das Gewässer "kippt um".
Phosphonat:
Phosphonat ist ähnlich dem Natriumtriphosphat einzustufen.
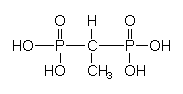
Phosphonat trägt zur Eutrophierung von Gewässern durch den Düngereffekt wesentlich weniger bei als das oben besprochene Triphosphat. Die Ursachen hierfür sind der pro Mol geringere Phosphorgehalt des Phosphonates im Vergleich zum Triphosphat und die gleichzeitig etwa dreifach höhere Metall-Ionenbindungskapazität (-> Tab. 14). Dadurch kann bei gleicher Enthärterwirkung der Phosphoreintrag gegenüber dem Triphosphat um 80 % verringert werden (s. u.).
Polycarboxylate:
Polycarboxylate haben als wasserlösliche Ionenaustauscher ebenfalls
eine schnelle Wirkung bei der Wasserenthärtung. Ihr Umweltverhalten
ist zurzeit noch unzureichend aufgeklärt. Bisher sind
aber keine nachteiligen Wirkungen bekannt geworden. Der
biologische Abbau erfolgt allerdings nur langsam.
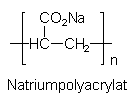
Bei der Wasserenthärtung werden je zwei Natrium-Ionen des Natriumpolyacrylats durch ein Calcium- oder Magnesium-Ion ersetzt. Diese Ionenaustauschreaktion ist deutlich schneller als die Ionenaustauschreaktion von Zeolith A (s. u.). Zeolith A (Sasil), das zunehmend das Triphosphat verdrängt, wird meist in Kombination mit Polycarboxylaten verwendet, um eine schnelle Anfangsenthärtung zu erreichen.
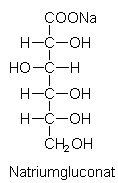
Gluconat:
Gluconat ist ein Enthärter ohne Düngereffekt, der schnell wirkt und
außerdem gut abbaubar ist. Gluconat wird aus Glucose hergestellt.
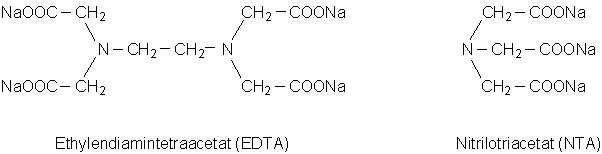
EDTA:
EDTA (Ethylendiamintetraacetat) und NTA (Nitrilotriacetat) sind
schnell wirkende Enthärter. Diese Verbindungen bilden sehr
stabile Komplexe mit Calcium-Ionen, aber auch mit anderen
Metall-Ionen. Daher können auch giftige Schwermetalle aus
Sedimenten remobilisiert werden, die dann in das Wasser und
somit in die Nahrungskette gelangen können. EDTA und NTA
werden nur langsam abgebaut und in Kläranlagen nicht
zurückgehalten.
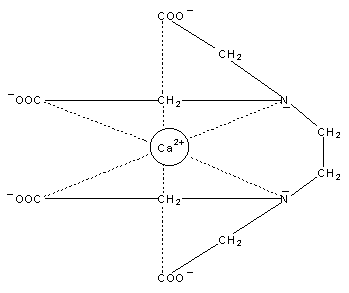
Die folgende Abbildung (-> Abb. 6) zeigt den Calcium-Komplex von EDTA.
Citronensäure:
Citronensäure wirkt wasserenthärtend, indem es vor allem im schwach alkalischen Milieu Calcium-Ionen
unter Bildung löslicher Komplex-Anionen bindet:
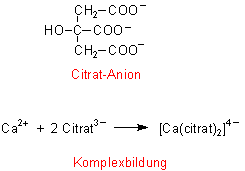
Citrat hat fast keinen Düngemitteleffekt, ist biologisch vollständig abbaubar und ungiftig. Ein Nachteil ist die schlechte Wirkung bei mittleren bis hohen Waschtemperaturen, da dann festes Ca3(citrat)2 ausfällt.
Seife:
Seife bindet die härtebildenden Ionen als unlösliche
Fettsäuresalze. Calcium-Ionen werden in Form von Kalkseife
gebunden (-> 4.5.1).
Seife ist ein ungiftiger und vollständig biologisch abbaubarer Wasserenthärter. Allerdings erfordert der Abbau sehr viel Sauerstoff:
Zum Beispiel sind bei Normalbedingungen zum Totalabbau von 1 kg Seife (Kalkseife) ungefähr 2000 l Sauerstoff notwendig, der dem Wasser entnommen wird. Da zur Fällung von einem Calcium- oder Magnesium-Ion zwei Seifeanionen erforderlich sind, benötigt man zur Enthärtung recht große Mengen (-> Tab. 14).
Zeolith A (Sasil):
Zeolith A ist ein Natriumaluminium-Silicat der chemischen
Zusammensetzung: x Na2O · y Al2O3 ·
z SiO2.
Der Handelsname "Sasil" ist aus dem englischen Namen sodium
aluminium silicate abgeleitet. Zeolith A wirkt als
Ionenaustauscher.
Die härtebildenden Ionen werden gegen Natrium-Ionen
ausgetauscht. Da das Zeolith wasserunlöslich ist, kann es durch
Sedimentation aus dem Wasser entfernt werden. Zeolith A hat
keinen Düngereffekt und ist ungiftig. Es erfordert als anorganische
Substanz keinen biologischen Abbau. Für Zeolith A konnte bisher
keine Schwermetallmobilisierung festgestellt werden.
Beim Waschen bleibt es feindispers in der Waschlauge verteilt,
allerdings muss eine geringfügige zusätzliche Tensidmenge
verwendet werden, um die Dispersion aufrechtzuerhalten.
Der wesentliche Nachteil dieses Enthärters liegt im vergleichsweise langsamen Einsetzen der Wirkung. Um beim Waschvorgang die Anfangshärte des Wassers schnell zu vermindern, ist deshalb in der Regel ein zusätzlicher, schnell wirkender Enthärter (Coenthärter) erforderlich. Letzterer kann aber sparsam verwendet werden, da die Hauptenthärtung durch das Zeolith erreicht wird.
Zeolith A ist nach heutigem Kenntnisstand der umweltverträglichste Wasserenthärter. Seine Verwendung in Waschmitteln hat sich weltweit (ohne Planwirtschaftsländer) von 277.000 t (1982) auf 1.2 Mio. t (1990) mehr als vervierfacht. Im gleichen Zeitraum hat die Triphosphatverwendung sich von 2.8 Mio. t auf 2.0 Mio. t um fast 1/3 vermindert, da Triphosphat vor allem durch Zeolith und andere Enthärter ersetzt wurde.
4.5.3 Kapazität von Wasserenthärtern
Die zur Wasserenthärtung notwendige Enthärtermenge hängt von der Art des Enthärters und den jeweiligen Einsatzbedingungen ab. Die Tabelle 14 zeigt die temperaturabhängige Bindungskapazität von verschiedenen Enthärtern. Eine hohe Bindungskapazität ist wünschenswert, weil die zur Enthärtung notwendige Enthärtermenge mit steigender Bindungskapazität abnimmt.
1 g Phosphonat entspricht der Wirkung von über 4 g Seife. Da Vollwaschmittel etwa 20-30 % Wasserenthärter enthalten (-> 3.1), wird die Bedeutung der Bindungskapazität des Enthärters deutlich.
| Tab. 14: Bindungskapazitäten von Enthärtern in mg Ca2+-Ionen pro 1 g Enthärter [7] | ||
| Enthärter / Temperatur: | 20 °C | 90 °C |
| Phosphonat | 281 | 270 |
| NTA | 204 | 144 |
| Polycarboxylat | 200 | 170 |
| EDTA | 156 | 110 |
| Triphosphat | 113 | 81 |
| Zeolith | - | » 81 (bei 60 °C) |
| Citrat | 139 | 21 |
| Gluconat | 90 | - |
| Seife | » 65 | - |