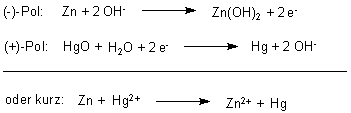
3 Quecksilber
Quecksilber ist eines der giftigsten Metalle. Der Grund für die Toxizität ist die extreme Stabilität seines Sulfids und seiner Komplexverbindungen, womit die hervorragende Bindefähigkeit von Quecksilber in organischem Material zu erklären ist (hochpersistentes Summationsgift). Hinzu kommt, dass das Metall langsam verdampft, so dass man in kontaminierten Räumen, in denen z. B. einmal ein Fieberthermometer zerbrochen ist, einer ständigen Belastung ausgesetzt ist. Trotz der hohen Toxizität sind Quecksilber und seine Verbindungen immer noch von großer technischer Bedeutung und dabei sehr billig. Die Gründe hierfür liegen in den vielfältigen Eigenschaften dieses Metalls:
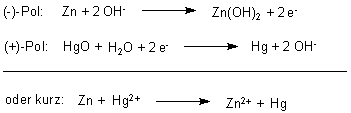
Die Reaktionen sind nicht umkehrbar, weil sich die Zinkelektrode bei Stromlieferung auflöst. Außerdem würde beim Ladevorgang eher Wasserstoff entstehen als Zinkmetall. Deshalb lassen sich Knopfzellen nicht wieder aufladen.
3.1 Quecksilber in der Umwelt
In die Umwelt gelangt Quecksilber hauptsächlich durch Deponierung oder Verbrennen von Abfällen. So verschwinden pro Jahr ca. 50 t dieses Umweltgiftes. Da es bei hohen Temperaturen als ideales Gas vorliegt und deshalb alle Filter ungehindert passiert, ist es auch im gefilterten Abgas von Müllverbrennungsanlagen zu finden. Gleiches gilt für die Abgase von Kohlefeuern, da die pflanzlichen Vorstufen der Kohle (Humusstoffe) gute Schwermetallsammler sind, die ähnlich wie Ionenaustauscher wirken.
Da Quecksilbersulfid im Wasser praktisch keine Ionen freisetzt, hält sich das hartnäckige Gerücht, dass man Quecksilber und seine Verbindungen entgiften kann, indem man sie in Sulfid überführt. Danach wird es üblicherweise im Mülleimer "entsorgt".
Auf der Mülldeponie können Bakterien das Sulfid aber zu metall-organischen Verbindungen extremer Giftigkeit (wie z. B. das gasförmige Methylquecksilber (CH3)2Hg umsetzen. (Problem von bebauten Altlasten. Das Gas findet sich zusammen mit Methan in schlagwetterverdächtigen Konzentrationen in den Kellerräumen.) Falls Quecksilbersulfid verschluckt wird, kann sich Methylquecksilber auch durch Darmbakterien bilden. In Müllverbrennungsanlagen wird Quecksilbersulfid thermisch gespalten und partiell oxidiert:
HgS + O2 ———> Hg + SO2
Somit gehören grundsätzlich alle Quecksilberreste und Quecksilberverbindungen in den Schwermetallabfall, wobei Quecksilber und seine Verbindungen wegen des hohen Dampfdrucks des flüssigen Metalls in geschlossenen Gefäßen aufbewahrt werden müssen.
3.2 Das Unglück in der Minamata-Bucht
Um 1950 kam es zu einer Quecksilbervergiftung von Fischern, die in der japanischen Minamata-Bucht fischten. Die Quecksilberverbindungen entstammten den Abwässern einer Fabrik zur Herstellung von Alkohol aus Ethin ("Carbidsprit"). Quecksilber spielt eine katalytische Rolle bei der Addition von Wasser an Ethin. Die Alkoholsynthese umfasst insgesamt drei Reaktionen:
1. Addition von Wasser an Ethin (Quecksilberkatalyse):
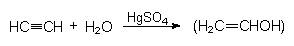
2. Umlagerung des instabilen Vinylalkohols zu Acetaldehyd:
3. Addition von Wasserstoff zur Reduktion des Aldehyds zu Ethanol: