5.8 Glas
Zum Thema Glas gibt es eine Schulwebseite. Schauen Sie einmal hinein: Unterrichtseinheit Glas.
Glas ist ein stofflich einheitliches anorganisches Schmelzprodukt, das abgekühlt und erstarrt ist, ohne merklich zu kristallisieren. (Diese Eigenschaft haben aber auch viele organische Stoffe vor allem aus dem Kunststoffsektor: Beispiele sind organische Gläser wie Plexiglas oder tiefgefrorenes Gummi; -> 5.12.)
Typisch für Gläser ist der plastische Zustand in gewissen Temperaturbereichen. Dieser liegt energetisch zwischen den Aggregatzuständen Fest und Flüssig.
Die Eigenschaften von kristallinen Festkörpern und Gläsern lassen sich wie folgt unterscheiden:
Nicht plastische Stoffe:
Plastische Stoffe:
Bemerkenswert ist, dass die hochviskose flüssige Masse stabiler zu sein scheint als die glasartig spröde Festmasse - stark abgekühltes Gummi splittert wie Glas (dies spielt beim Recycling von Autoreifen eine wichtige Rolle).
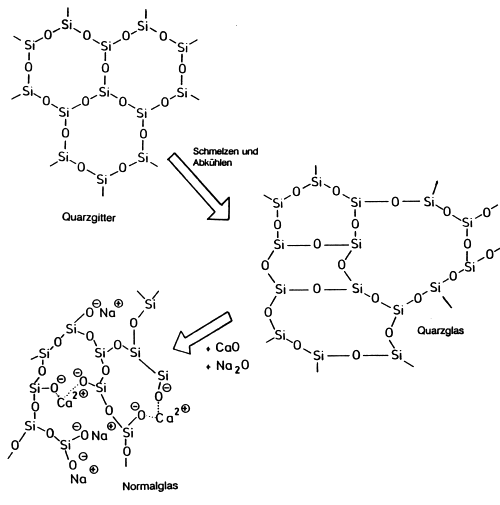
Zum Verständnis der Eigenschaften von Glas soll der molekulare Aufbau von Feststoffen wie Kaliumnitrat, Quarz und Glas verglichen werden (-> Abb. 25).
KNO3 ist einheitlich aus K+- und NO3¯-Ionen aufgebaut (Ionengitter). Jeder Baustein hat räumlich und energetisch exakt die gleiche Umgebung. Alle werden deshalb beim Erreichen eines bestimmten Energiegehaltes (charakterisiert durch eine Temperatur) schlagartig aus der Bindung gelöst. Folglich beobachtet man einen scharfen Schmelzpunkt von 339 °C. Der Vorgang ist reversibel.
Gleiches beobachtet man auch beim natürlichen Quarz SiO2, der völlig symmetrisch aus Si- und O-Atomen aufgebaut ist (Bergkristall, Molekülgitter; -> Abb. 25). Auch hier hat jeder Baustein räumlich und energetisch exakt die gleiche Umgebung. Quarz schmilzt scharf bei 1705 °C. Lässt man die Quarzschmelze abkühlen, können sich die kovalent gebundenen Bausteine nicht mehr regelmäßig zusammenfügen. Es existieren keine gleichen Umgebungen bzw. Bindungsstärken mehr. Deshalb brechen beim erneuten Schmelzen einzelne Bindungen nacheinander auf. Man beobachtet folglich keinen scharfen Schmelzpunkt mehr, sondern das typische Erweichen von Glas. Ein chemisch einfacher Glastyp, Quarzglas, ist entstanden.

| Abb. 25: | Quarzgitter (Tridymit), Quarzglas und Normalglas
(Die dritte Dimension, d. h. die vierte Bindung von Silicium, ist nicht gekennzeichnet.) |
Normalglas stellt man aus Quarz, Kalk und Soda her. Quarz ist ein Säureanhydrid. Er stellt das Netzwerk als Grundmatrix (Netzwerkbildner). Wenn man ihn mit basischen Oxiden wie CaO oder Na2O sintert, bricht das Gitter vollkommen ungeregelt auf (Netzwerkstörer). Dabei bilden sich nichtkristalline Silicate. Jeder Baustein hat nun energetisch Umgebungen mit unterschiedlicher Bindungsstärke aufzuweisen. Die Folge ist, dass die Bindungen bei Energiezufuhr nicht mehr simultan, sondern nacheinander aufbrechen. Dies ist der Grund für den weiten Erweichungsbereich von Glas.
5.8.1 Herstellung von Glas
Die wichtigsten Ausgangsstoffe sind Quarzsand (Glassand), Soda, Pottasche, Kreide oder Marmor, Mennige, Borax, Kaolin und Feldspat.
Benötigt werden Temperaturen um 1600 - 1800 °C, da die Ausgangssubstanzen sehr schwer schmelzbar sind. Ihr Schmelzpunkt sinkt allerdings mit zunehmender Sinterung, die bereits bei 600 - 800 °C einsetzt (Schmelzpunkterniedrigung). Hierbei setzen sich Kalk, Soda etc. unter beträchtlicher CO2-Freisetzung mit Quarz zu Silicaten um:
Bei dieser Säure/Base-Reaktion handelt es sich um den Austausch von Säureanhydriden.
Wegen des großen Erweichungsbereichs lässt sich Glas hervorragend bearbeiten (Glasbläserei). Flachglas wurde früher aus geblasenen Flaschen hergestellt. Die abgetrennten Böden nannte man "Butzen". Später wurde Glasschmelze gepresst oder gewalzt. Heute werden Portionen von sehr flüssigem Glas auf ein Bad mit einer Zinkschmelze gegossen und dann abgekühlt.
Zusammensetzung von Glas
Die Eigenschaften eines Glastyps variieren stark mit der
chemischen Zusammensetzung. Man kann Glas durch Variation der
Stoffe und deren relativer Mengen für fast jeden gewünschten
Zweck (wie mechanische oder thermische Stabilität oder optische
Eigenschaften) konstruieren:
| 1. | Netzwerkbildner (saure Bestandteile)
im allgemeinen Quarz, aber auch Phosphor- oder Arsenpentoxid, Bortrioxid B2O3 und Aluminiumoxid. Arsenoxid ist vor allem bei Gläsern für optische Zwecke unerlässlich. |
| 2. | Netzwerkstörer (basische Bestandteile)
Oxide von Ca, Na, K und Pb. |
| 3. | Trennstellenschließer
Zuschläge wie Boroxid oder das amphotere Aluminiumoxid sowie Alumo-Silicate (Kaolin, Feldspäte) sind zugleich Netzwerkbildner wie -störer. Sie schließen aufgrund der mittleren Wertigkeit III Trennstellen und sorgen für höhere Schmelzbereiche des Na/Ca-Glases (-> Duran-Gläser). |
Die folgende Übersicht zeigt die Zusammensetzung von einigen ausgewählten Glassorten (Angaben in Prozent):
Natron-Kalk-Gläser (Normalglas)
75,5 SiO2, 12,9 Na2O, 11,6 CaO.
Gewöhnliches Gebrauchglas, Fensterglas.
Kali-Kalk-Gläser (Böhmisches Kristallglas)
76 SiO2, 14,1 K2O, 6,7 CaO, 2,3 Na2O,
0,5 As2O5, 0,1 Al2O3, 0,3
SO3.
Gläser für feingeschliffene Gegenstände.
Bor-Tonerde-Gläser (Jenaer Glas)
74,5 SiO2, 8,5 Al2O3,
4,6 B2O3, 7,7 Na2O, 3,9 BaO, 0,8 CaO, 0,1 MgO.
Gegen Chemikalien und große T-Differenzen beständig.
Supremax-Glas
56,4 SiO2, 20,1 Al2O3, 8,9 B2O3,
8,7 MgO, 4,8 CaO, 0,6 Na2O, 0,6 K2O.
T-beständig bis 1000 °C.
Kali-Blei-Gläser (Bleikristallglas)
56 SiO2, 32 PbO, 11,4 K2O, 0,1 Al2 O3,
0,5 As2O5.
Gläser, Lüster und Linsen mit starkem Lichtbrechungsvermögen.
Weitere Informationen zur Glasherstellung
Farbgeber
Farbige Gläser entstehen vor allem bei Zusatz von Schwermetalloxidspuren:
| CoO | Blau | Fe2O3 | Gelbbraun |
| Cr2O3 | Smaragdgrün | MnO2 | Violett |
| CuO | Blaugrün | U3O8, NiO | Gelb |
| FeO | Grün | Au, Se | Rubinrot |
Glasuren
Glasuren sind Gläser mit einem höheren Anteil an Netzwerkstörern
und schmelzen deshalb niedrig. Beliebt sind vor allem bleihaltige
Glasuren, die allerdings empfindlich gegen Korrosion sind und
Nahrungsmittel kontaminieren können.
Lüsterfarben
Hierunter versteht man aufgedampfte Schwermetall(verbindungen)
wie Cd. Diese waren besonders auf Jugendstilgläsern beliebt.
Mattglas
Wenig transparente Gläser produziert man durch Anätzen mit
Fluoriden oder Flusssäure oder durch Einwirkung von Sandstrahlgebläsen.
Opalglas
Setzt man von vornherein Calciumfluorid zur Glasschmelze zu, so
erhält man durchgehend milchiges Glas (Odolflasche).
Spiegel
Spiegelüberzüge (und Christbaumschmuck) werden vor allem durch
Reduktion von Silbernitrat beschichtet. Reduktionsmittel ist Glucose
im basischen Milieu.
5.8.2 Stabilität von Glas
Mechanische Stabilität von Gläsern
Bekannt ist die Sprödigkeit von Glas.
Die Stabilität ist aber auch eine Frage der Einwirkungsdauer: Rasche Einwirkung bewirkt Bruch oder reversible Deformation. Langanhaltende, vorsichtige Einwirkung bewirkt bleibende Deformation: Z. B. können Fensterscheiben nicht beliebig groß gemacht werden, da sie unter ihrem eigenen Gewicht fließen.
Die reale Festigkeit des Glases wird durch die Festigkeit der Oberfläche und nicht durch die des gesamten Materials bestimmt. Oberflächliche Kratzer erhöhen die Instabilität beträchtlich (Glasschneiden durch Ritzen mit einem Diamanten). Ein wirksamer Schutz der Oberfläche steht deshalb im Mittelpunkt der Glasforschung. Entsprechende Oberflächenbehandlungen und -versiegelungen ermöglichen Gewichtsersparnis bei der Glasherstellung (leichte Getränkeflaschen).
Verbundglas
Hierunter versteht man Mehrschichtglas mit Kunststofffolien
zwischen den einzelnen Schichten. Diese fangen Sprungrisse auf
und verstärken Glas gegen mechanische Einwirkungen (Bankschalterglas).
Thermische Stabilität von Glas
Glas ist gegen extreme Temperaturunterschiede empfindlich. Diese
Eigenschaft ist allerdings über die Zusammensetzung steuerbar. So
kann man den Molekülbindungsanteil durch Quarzzusatz steigern.
(Quarzglas ist besonders stabil gegen thermische Schocks.) Positiv
wirken sich auch Trennstellenschließer aus.
Sicherheitsglas
Glas mit gezielten thermischen Spannungen, das bei mechanischer
Einwirkung spontan in kleine Stücke zerfällt (Autoscheiben).
Chemische Stabilität von Glas
Glas ist ein inerter Werkstoff. Einige Einschränkungen sind jedoch
zu machen:
Glasoberflächen nehmen Wasser auf und quellen dabei unter Bildung einer recht empfindlichen Schicht. Heißes Wasser löst Metall-Ionen heraus. In sauren Lösungen findet ein Ionenaustausch zwischen Lösung und Oberfläche statt:
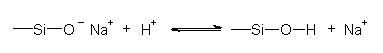
In basischen Lösungen beobachtet man Trübung aufgrund von Anätzung durch OH¯-Ionen, die mit polymeren Silicaten bzw. Kieselsäure reagieren (Netzwerkkorrosion):
Hier sei an Haushaltsmittel mit starken Alkalien wie Rohrreiniger oder basische Desodorans erinnert, die leicht Glasuren (Badewanne, Toilettenbecken) angreifen. Durch weniger saure Netzwerkbildner wie Al2O3 steigert man die chemische Resistenz (spülmaschinenfeste Gläser).
5.8.3 Glasherstellung und Umwelt
Obgleich Glas ein ausgesprochen inerter Werkstoff ist, treten dennoch Umweltbelastungen auf. Beispiele sind:
Herstellungsbedingte Probleme
Glasmüll
Kontaminanten
5.8.4 Glasrecycling
Aus ökologischen Gründen ist deshalb die Mehrwegflasche zu begrüßen. Der Nutzen gegenüber der Getränketüte wird allerdings kontrovers diskutiert.
Dagegen lohnt sich die Verarbeitung von Abfallglas. Sie ist gesetzlich entsprechend verankert. Das Problem ist aber die stoffliche Inhomogenität von Altglas, so dass nur billige Hohlgläser oder Fensterglas daraus gewonnen werden können. Neben dem Schwermetalleintrag ist vor allem die Vermischung von Weißglas mit Buntglas zu nennen. Geringste Spuren von grünem Glas verunreinigen große Mengen Weißglasschmelze. Hier hilft die sog. Glasmacherseife, Braunstein MnO2, die das Glas selbst violett färbt, aber aufgrund der additiven Farbmischung Violett + Grün => Farblos durch einen optischen Trick entfärbend wirkt.
Fluoridhaltige Odolflaschen machen bereits bei 1-2 % Anteil Altglas unbrauchbar.
Problematisch sind auch Schwermetallverschlüsse, die in die Glasschmelze gelangen und die chemische Zusammensetzung der Glasmasse verändern können. Aluminiumreste von Verschlüssen und Manschetten reduzieren Glas zu Silicium, das als schwarze Einschlüsse zu sehen ist und die Stabilität des Glases mindert.