 |
 |
| Bild 1: Wirkung von Saurem Regen auf Sandstein (rechts)
(Fotos: Blume) |
Saurer Regen
 |
 |
| Bild 1: Wirkung von Saurem Regen auf Sandstein (rechts)
(Fotos: Blume) |
Was ist Saurer Regen?
Regen galt früher als die saubere Wasserquelle überhaupt. Regenwasser wurde
bezüglich seiner Reinheit mit destilliertem Wasser gleichgesetzt. In weichem
Regenwasser spülte man die Wäsche und wusch man seine Haare. Mit Regenwasser
bereitete man Speisen zu.
Abgesehen davon, dass das mit der Reinheit früher auch schon lange nicht mehr
stimmte: Heute weiß man, dass im Regenwasser eine Vielzahl von Schadstoffen gelöst
sind, die den pH-Wert des Wassers sauer einstellen. Man spricht von Saurem
Regen.
Seit wann kennt man das Phänomen?
Lange Zeit handelt es sich beim Sauren Regen um örtlich begrenzte Phänomene. Man
beobachtete z. B. schon im antiken Rom, dass in der Nähe von Pyrit oder Bleiglanz
verarbeitenden Metallfabriken die Bäume abstarben. Bei der Sodaherstellung stank
der Schwefelwasserstoff zum Himmel. Der außerdem emittierte Chlorwasserstoff
versauerte die Oberflächengewässer.
Aber erst in den späten 70er Jahren des 20. Jahrhunderts wurde man sich plötzlich
großräumigen Waldsterbens und landesweiter Seenversauerung bewusst. In
Schweden war das Phänomen der absolut sauberen, kristallklaren Seen zuerst
beobachtet worden: Weil es ohne jegliches Leben war. Der pH-Wert dieser Seen lag
teilweise unter 3, entsprach also dem von Haushaltsessig. Der Begriff des Giftigen
oder des Sauren Regens kam auf. Aber erst 1979 gab es erste Pressemitteilungen zur
Versauerung von Seen in Schweden.
Die damaligen Zeitungsmeldungen bedürfen noch einer Korrektur: Es waren nicht die Emissionen aus der BRD, die Schwedens Seen "vergifteten", sondern die Abgase aus den Industriegebieten Mittel-Englands.
Wie Saurer Regen entsteht
1. Verbrennungsprodukte sind Säureanhydride
Bei Verbrennungsprozessen entsteht eine Reihe von Nichtmetalloxiden. Diese können
gasförmig sein oder sich als Aerosole verteilen. Sie bilden als Säureanhydride mit
Wasser Säuren. Hierbei laufen mit Wasserdampf Reaktionen ab, von denen die
meisten in chemischen Gleichgewichten münden.
Kohlenstoffdioxid:
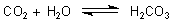
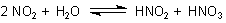
Stickoxide:
Schwefeloxide:
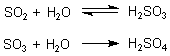
Salzsäure entsteht durch Reaktion von Chlorwasserstoff mit Wasser. Das HCl-Gas entweicht bei Verbrennungen, z. B. von PVC oder von chlorierten Kohlenwasserstoffen (CKW).
2. Radikale reagieren mit Nichtmetalloxiden
Die meisten Säuren können sich aber auf anderem Wege bilden. Einen Hinweis
darauf, wie das ablaufen könnte, gibt das Auftreten von Wasserstoffperoxid H2O2 im
Sauren Regen. Das bildet sich z. B. aus Hydroxyl-Radikalen:
2 HO· ———> H2O2
Sie reagieren auch mit den oben erwähnten und anderen Nichtmetalloxiden zu Säuren:
CO + 2 HO· ———>
H2CO3
NO + HO· ———> HNO2
NO2 + HO· ———>
HNO3
SO2 + 2 HO· ———>
H2SO4
Diese Radikale sind das Waschmittel der Atmosphäre und sind auch an der bodennahen Ozonbildung beteiligt. Sie entstammen primär aus stratosphärischem Ozon und Wasser und gelangen bei Hochdruckwetterlage zur Erdoberfläche.
O3 + H2O ———> O2 + 2 HO·
Was die Säuren im Sauren Regen bewirken
Die Säuren regnen auf uns herab. Das geschieht heute nicht mehr lokal begrenzt wie
früher, sondern großflächig, kontinental. Wir beobachten ihre Wirkung an Bauwerken
und an Pflanzen.
Einige Beispiele:
Kalkstein reagiert mit Schwefelsäure zu Gips. Damit verbunden ist eine
Kristallvergrößerung. Das Bauwerk bröckelt. Aber auch Sandstein zefällt (-> Bild oben).
Pflanzen verfärben sich unter Einwirkung von Säuren.
Die Böden versauern. Böden sind normalerweise gute Puffersubstanzen. Wie alle
Puffer haben sie aber nur eine bestimmte Kapazität. Ist diese erschöpft, werden die
Böden zersetzt. Sie verlieren damit auch ihre
Ionenaustauscherwirkung. Die Säuren stören somit
den Stoffwechsel der Wurzeln, die Bäume verhungern.
Die Bäume und Pflanzen werden aber auch vergiftet. Denn der Saure Regen löst
Aluminium-Ionen aus den Tonmineralien der Böden heraus. Al-Ionen sind in hohen
Konzentrationen pflanzentoxisch.
Insgesamt muss man aber deutlich sagen: Es handelt sich bei dem Phänomen
"Waldsterben" um ein äußerst komplexes Geschehen, bei dem der Saure Regen nur
eine Systemkomponente unter vielen ist.
 |
| Bild 2: Waldsterben (Teutoburger Wald bei Bielefeld)
(Foto: Blume) |
Zur Chemie mit Wasserstoffperoxid haben wir eine große
Webseitengruppe.
Weitere Texte zum Thema „Abgas“