
Ohne Ascorbinsäure bröckelt das Brot (Asco-Test, Taubers Reagenz)
Experimente:
Versuch: Berliner Blau-Probe zum Nachweis von Ascorbinsäure
Versuch: Halbquantitativer Nachweis von Ascorbinsäure in Mehl mit Taubers Reagenz
("Asco-Test")
Jeder kennt die handelsüblichen Backzutaten Mehl, Wasser, Hefe und Salz. Aber in den
Großbäckereien werden für die Qualitätssicherung der Backprodukte noch andere Zusatzstoffe
eingesetzt. Einer davon ist die Ascorbinsäure.

Die Ascorbinsäure spielt eine große Rolle als Teigstabilisator. Dazu muss man wissen, dass Mehl ein Eiweiß enthält, das dem Teig seinen Zusammenhalt gibt: Gluten. Dieses "Klebereiweiß" besitzt elastische und plastische Eigenschaften, so dass der Teig die Gärgase halten kann. Durch die Hitzedenaturierung bildet sich beim Backen dann das feste, zugleich porige Gebäckgerüst.
Im Mehl ist jedoch ein Tripeptid enthalten, das diesen Prozess stört: Glutathion. (Seine Struktur ist g-Glu-Cys-Gly.) Es reagiert beim Erhitzen mit dem Klebereiweiß. Dabei verändert sich dessen Struktur derart, dass die Stabilität des Teiges abnimmt. Um Glutathion unschädlich zu machen, wird Ascorbinsäure eingesetzt.
Diese wird zunächst enzymatisch zu Dehydroascorbinsäure oxidiert. Letztere oxidiert zwei Glutathionmoleküle, wobei Glutathiondisulfid entsteht.
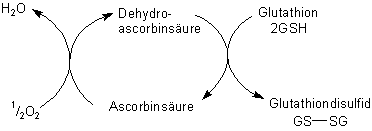
Durch diese Reaktion wird Glutathion ausgeschaltet.
Somit verhindert Ascorbinsäure die durch chemische Bestandteile der Teigmasse bewirkte schädliche Veränderung des Klebereiweißes. Da das Mehl keine Ascorbinsäure enthält, muss sie vorm Backen zugesetzt werden. Die Menge beträgt etwa 2-6 g/100 kg Mehl.
Wie macht der Bäcker den so genannten "Asco-Test"?
Es handelt sich um eine halbquantitative Probenmethode (-> Versuch).
Zunächst wird das Mehl "passiert", d. h. auf einem Brett ausgestrichen, als dünne Schicht festgedrückt und
in Wasser gedrückt. Dann wird es mit einer frisch zubereiteten Mischung
von Lösungen des roten Blutlaugensalzes bzw. von Eisen(III)-chlorid beträufelt. Enthält das Mehl
Ascorbinsäure, so bilden sich blaue Punkte. Ursache: Ascorbinsäure reduziert Eisen(III) zu Eisen(II).
2 Fe(III) + AscH2 ———> 2 Fe(II) + Ascox + 2 H+
Das Eisen(II) bildet dann mit Blutlaugensalz Berliner Blau.
Dieser Test lässt zwar keine Aussage über den genauen Ascorbinsäuregehalt des Mehls zu; dennoch kann ein Fachmann zumindest feststellen, ob die Ascorbinsäurebehandlung in zwei verschiedenen Mehlproben in etwa gleich ist oder wie gut die Ascorbinsäure im Mehl verteilt ist.

Bäckerprobe auf Ascorbinsäure im Mehl
(Foto: Norbert Stanni, Dubai/Vereinigte Emirate)
Anmerkungen zu Taubers Reagenz
Wie bei vielen Rezepturen zu Nachweisreagenzien bedarf es auch bei Taubers Reagenz Erklärungen,
warum man so und nicht anders verfährt.
Erst einmal muss man sagen, dass in der Literatur Taubers Reagenz in zweifacher Hinsicht bekannt ist:
Einmal als Nachweisreagenz auf Ascorbinsäure - so wie es im -> Versuch
beschrieben wird.
Dann gibt es eine Variante, die zum Nachweis von Ascorbinsäure vor allem im Mehl genutzt wird (->
Versuch).
Fragen zu Taubers Reagenz für Mehl, die sich automatisch stellen
Was wird mit dem Fe(II)? Das darf doch nicht mehr in der Lösung sein, weil es sich dann mit KHF(III)
sofort zu Berliner Blau umsetzen würde.
Ein Teil wird schon beim Kochen oxidiert.
Warum der KMnO4-Zusatz?
Der oxidiert das gesamte Fe(II) zu Fe(III) und sorgt für stabile Redox-Verhältnisse.
Warum wird bei der Versuchsvorschrift 1 das Mehl blau, obwohl sich keine
Ascorbinsäure darin befindet?
Fe(III) wirkt in neutraler oder alkalischer Lösung stark oxidierend. Deshalb wurde im Mehl alles oxidiert,
was irgendwie angreifbar war. Das Milieu von Taubers Reagenz dagegen ist sauer
a) wegen des Eisen(II)-Salzes (saure Hydrolyse),
b) wegen des Zusatzes an Phosphorsäure.
Damit ist das Redoxpotential von Fe(III) niedriger. Es wird nicht mehr alles oxidiert, was im Mehl enthalten ist.
Warum bildet Fe(III) nicht schwerlösliches Eisenphosphat?
Phosphorsäure zählt zu den schwachen Säuren. Ihre recht konzentrierte Lösung enthält zu wenige freie
Phosphat-Anionen, so dass das Löslichkeitsprodukt von FePO4 nicht erreicht wird.
Weitere Texte zum Thema „Ascorbinsäure“