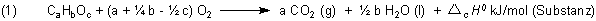
Verbrennungswärmen (Verbrennungsenthalpien)
Die Verbrennungswärme ist definiert als die negative Enthalpieänderung im Verlauf einer Verbrennungsreaktion. Gleichung (1) zeigt die Reaktionsgleichung für organische chemische Verbindungen.
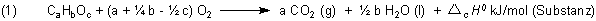
In dieser Gleichung ist die Energieänderung (Reaktionsenthalpie) als Quasi-Reaktionspartner mit berücksichtigt. Damit beschreibt die Gleichung ein abgeschlossenes System. Das ist - wie wir gleich sehen werden - hilfreich bei verschiedenen Berechnungen und Überlegungen.
Wie bei den Bildungsenthalpien gesehen gibt es hier auch Standardenthalpien. Ihr Symbol ist Δc H 0. Der Index c steht für engl. combustion, Verbrennung. Der Standard ist stöchiometrischer (molarer) Umsatz bei 298 K und 1,013 bar. Das Produkt Wasser fällt dann als Flüssigkeit an (Symbol: (l) für engl. liquid, flüssig).
Achtung: Obwohl in der Chemie bei exothermen Reaktionen die Enthalpieänderung auf das System bezogen stets ein negatives Vorzeichen hat, haben (Standard)Verbrennungsenthalpien definitionsgemäß stets ein positives Vorzeichen.
Das ist wohl ein Entgegenkommen gegenüber den wirtschaftlich denkenden Heizungsingenieuren… (Zur Vorzeichendiskussion bei Enthalpien klicke hier.)

Die Verbrennungsenthalpien kann man mit Hilfe eines Kalorimeters messen. Man kann sie aber auch mit Hilfe der Standardbildungsenthalpien berechnen. Übrigens sind die Verbrennungsenthalpien von Elementen wie C und H2 gleichzeitig die Standardbildungsenthalpien ihrer Oxidationsprodukte (hier CO2 (g) und H2O (l)).
Es gilt allgemein:

Als Reaktionsbeispiel wählen wir die Verbrennung (combustion) von Methan zu gasförmigem CO2 und flüssigem Wasser.
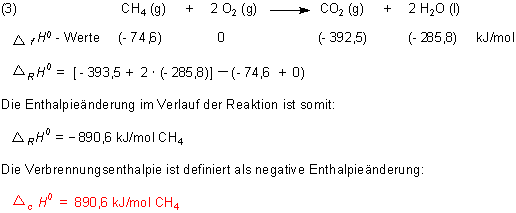
Wenn man verstanden hat, wie sich Enthalpien zusammensetzen, kann man damit trefflich spielen. Zum Beispiel kann man ja mal folgende Reaktionen vergleichen:
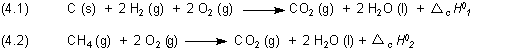
Die Differenz der Verbrennungsenthalpien sollte die Bildungsenthalpie von Methan ergeben.

Am besten gelangt man zu dem gewünschten Ergebnis, wenn man die Reaktionsgleichungen (4.1) und (4.2) subtrahiert. Dazu geht man nach den Regeln der Algebra (oder Buchstabenrechnung) vor.
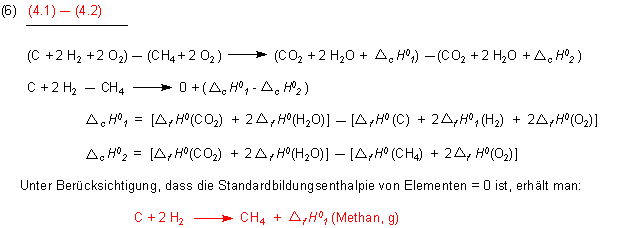
Man erhält auf diese Weise tatsächlich die Bildungsreaktion von Methan aus seinen Elementen. Die zugehörige Energieänderung ist wie erwartet seine (Standard-)Bildungsenthalpie.
Letztlich ist alles eine Anwendung des Heßschen Satzes. Um das zu verdeutlichen, kann man die Gleichung (5) auch graphisch darstellen. Dabei muss man unbedingt die Vorzeichen der Enthalpien beachten!

Der Heßsche Satz besagt, dass der Übergang von einem Zustand in den anderen unabhängig vom Weg ist. Das heißt, dass ausgehend vom Zustand [C + 2 H2] der Zustand [CO2 + 2 H2O] auch über den Zwischenzustand [CH4] erreicht werden kann.
Auf diese Weise kann man endlich auch verstehen, wie Bildungsenthalpien für Verbindungen berechnet werden können.
Das alles ist ja eigentlich ganz einfach…
Weitere Texte zum Thema „Energie und Chemie“