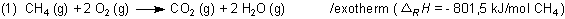
Reaktionswärme und Standardbildungsenthalpien
In der Thermodynamik steht die Berechnung von Energieumsetzungen bei Zustandsänderungen von Systemen im Mittelpunkt. Dabei interessieren vor allem die Energieumwandlungen bei chemischen Reaktionen. Es geht um die Energieänderung (Energiedifferenz) zwischen dem Zustand, der durch die Energieinhalte der Edukte gekennzeichnet ist, und dem Zustand, der durch die Produkte charakterisiert wird.
Die Reaktionswärme (Reaktionsenthalpie)
Von Interesse ist bei chemischen Umsetzungen stets die Reaktionswärme oder besser die
Reaktionsenthalpie. Ihr Symbol ist ΔR H.
Das ist die Energie, die bei einem chemischen Vorgang umgesetzt wird, zum Beispiel bei einer Verbrennung.
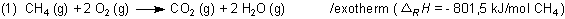
Für diese spezielle Reaktion kann man die Reaktionsenthalpie leicht ermitteln. Dazu mischt man im stöchiometrischen Verhältnis die Edukt-Gase und leitet die Reaktion ein. Man muss nun mit einem Kalorimeter die freigesetzte Wärme messen.
Zum Vorzeichen der Reaktionsenthalpien
Bei der Betrachtung der Energieumwandlungen steht immer das Reaktionssystem im Mittelpunkt. Das betrifft vor
allem die Vorzeichen. Wird Energie hineingesteckt, bekommt der Energiewert ein positives Vorzeichen. Entweicht
Energie aus dem System, so wird das Vorzeichen negativ. Im ersten Fall sprechen wir von endothermen Reaktionen,
im zweiten Fall von exothermen Reaktionen.
(Hier werden von Anfängern die meisten Fehler gemacht. Erschwerend ist, dass die Techniker anders herum denken: Für die steht das Außen im Mittelpunkt, denn sie wollen mit der Energie ihre Maschinen antreiben, wobei sie einen wirtschaftlichen Gewinn erzielen. Deshalb tragen die Energiewerte exothermer Reaktionen bei den Technikern ein positives Vorzeichen. Die endothermen Reaktionen verursachen Energiekosten; die Energiewerte bekommen also ein negatives Vorzeichen verpasst.
Vorsicht ist aber geboten: Auch in chemischen Tabellenwerten *) werden vereinbarungsgemäß die Verbrennungsenthalpien - anders als die „normalen“ Reaktionsenthalpien - mit einem positiven Vorzeichen versehen!
Bei der vergleichenden Diskussion der Werte muss man auch darauf achten, für welche Stoffmengen die Enthalpien ausgewiesen sind. Meistens beziehen sich die Werte auf ein Mol eines umgesetzten Stoffs (Edukt) oder des Produkts.
Oft genug beziehen sich die angegebenen Enthalpiewerte auch auf einen Formelumsatz. Das sei am Beispiel der Wassersynthese verdeutlicht:
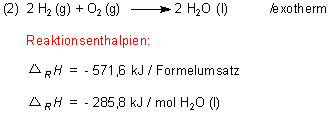
Bildungswärme (Bildungsenthalpie)
Die Bildungswärme bzw. Bildungsenthalpie beschreibt den Energieumsatz bei der Bildung
einer Verbindung aus ihren Elementen. Den Elementen hat man die Bildungsenthalpie 0 zugeordnet. Ihr Symbol ist
Δf H. (Das f steht für engl. formation, Bildung, Entstehung.)
Oftmals handelt es sich um eine formale Reaktion, die so nicht einfach durchzuführen ist.
Als Beispiel sei die Bildung von Methan aus Graphit und Wasserstoff genannt:

Umgekehrt ist die Bildungsenthalpie (allerdings mit entgegen gesetztem Vorzeichen!) auch diejenige Energie, die aufzuwenden ist, um eine Verbindung in ihre Elemente zu spalten. Ein solcher Vorgang spielt eine wichtige Rolle beim Cracken von Methan, um zum Beispiel für die Ammoniaksynthese Wasserstoff herzustellen. Dabei fällt als Koppelprodukt der industriell überaus wichtige Graphit in Form von Ruß an.
Wie man zur Bildungsenthalpie von Methan gelangt, beschreiben wir hier.
Standardbildungsenthalpie
Üblicherweise bezieht man die Bildungsenthalpie auf den Zustand der Elemente sowie der Verbindung bei thermodynamischen
Standardbedingungen 298 K und 1,013 bar. Man spricht dann von Standardbildungsenthalpie. Deren Symbol ist
Δf H 0.
Zur Basis hat man dem bei 298 K stabilsten Zustand der Elemente die Standardbildungsenthalpie 0 zugewiesen.
Das ist bei Modifikationen wichtig. So hat C(Graphit) 0 kJ/mol, C(Diamant) aber schon +1,9 kJ/mol. Klicke hier.
Wie man die Standardbildungsenthalpien ermittelt
Die Werte der Standardbildungsenthalpie von gängigen chemischen Verbindungen kann man Tabellenwerken *) entnehmen. Aber
Lernende fragen sich immer wieder, wie denn diese Werte zustande kommen. Vor allem, wenn die Elemente die Enthalpie 0 haben,
und wie kann dann als Summe ein diskreter Wert herauskommen. Hier ist als Beispiel die Standardbildungsenthalpie für CO2.
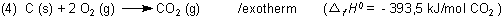
Ein Blick in gängige Tabellenwerke *) zeigt, dass es sich um den gleichen Wert wie für die Energieänderung bzw. Reaktionsenthalpie bei der Verbrennung von Kohlenstoff handelt. Standardbildungsenthalpien zumindest von Elementen kann man also experimentell ermitteln.
Bei der Messung zur Bestimmung der Standardbildungsenthalpie von CO2 geht man bei 298 K und 1,013 bar von den Elementen Kohlenstoff und Sauerstoff aus. Man lässt die Reaktion ablaufen und kühlt das System wieder auf 298 K ab; zugleich wird auch für Druckausgleich gesorgt. Wenn man dabei alle Energien „einsammelt“, die anfallen, erhält man den tabellierten Wert.
Es sei aber gleich gesagt, dass das nicht bei allen Substanzen so einfach ist. Man denke nur an Reaktionen wie die Bildung von CO aus den Elementen. Es gibt aber viele Tricks und Umwege, um zu den gewünschten Werten zu gelangen. Ein Stichwort ist der Heßsche Satz.
Wie man auch mit Hilfe der Verbrennungsenergien zu den Bildungsenthalpien gelangt, zeigen wir auf einer besonderen Webseite.
Vom Sinn der Standardbildungsenthalpien
Wenn man herausbekommen will, wie groß die Reaktionsenthalpie bei einer chemischen Umsetzung ist, bedient man sich der
Standardbildungsenthalpien.
Will man z. B. Methan verbrennen, so kann man schon vorher die Reaktionsenthalpie ermitteln:
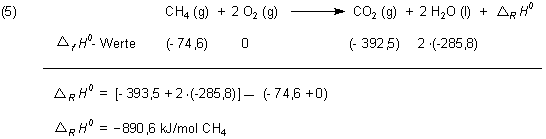
Die so berechnete Standardreaktionsenthalpie ist (mit der oben gemachten Einschränkung, was das Vorzeichen angeht) die Standardverbrennungsenergie (Symbol Δc H 0).
Allgemein gilt:
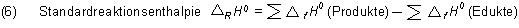
Auf einer gesonderten Webseite zeigen wir die Rechnungen für ein chemisches Gleichgewicht. Klicke hier.
Standardbildungsenthalpien sind abhängig vom Aggregatzustand
Standardbildungsenthalpien von Substanzen sind im flüssigen Zustand größer als die im gasförmigen Zustand.
Nehmen wir das Beispiel „Wasserbildung“.
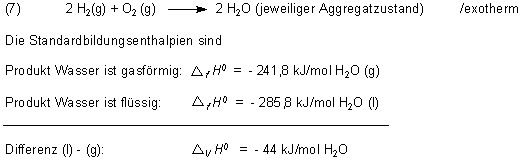
Die Differenz ist (wen wundert´s) die Verdampfungsenthalpie von Wasser mit der Starttemperatur 298 K (25 °C).
Um den Unterschied zwischen Flüssig und Gasförmig zu erklären, erinnern wir uns: Enthalpien können zwischen Reaktionssystem und Umgebung ausgetauscht werden. Im konkreten Fall der Wasserbildung ist sie (da negativ) für außen verfügbar - zum Beispiel zum Antrieb von Maschinen. Jetzt gibt es zwei Möglichkeiten, die technisch auch realisiert werden:
| - | Wenn die Reaktion nur bis zur Bildung von Wasserdampf geführt wird, so enthält das Reaktionssystem noch latente Verdampfungsenergie, die so nicht zur Arbeitsleistung zur Verfügung steht. Das bedeutet wirtschaftlichen Verlust. |
| - | Kondensiert man auch noch den Wasserdampf, so wird zusätzlich auch die bislang gespeicherte latente Verdampfungsenergie nach außen abgegeben und vergrößert auf diese Weise die mögliche Arbeitsleistung. Damit wird der absolute Wert der Standardbildungsenthalpie größer. |
Die Kondensation von Verbrennungsgasen ist deshalb ein gängiges Verfahren für Kraftwerksbetreiber, Energieausbeuten zu erhöhen.
*) D. R. Lide: Handbook of Chemistry and Physics. 89th Eddition; CRC-Press 2008
Weitere Texte zum Thema „Energie und Chemie“