Wie stabil sind Diamanten?
Die mechanische Stabilität von Diamanten gilt als sagenhaft
Adamas bedeutet im Griechischen so viel wie "unbezwingbar". Das gilt für den
Diamanten aber leider nur dann, wenn man beim Bearbeiten eines Kristalls gewisse
Regeln einhält und nicht aus Versehen die falsche Symmetrie-Achse des Kristalls trifft.
Dann zersplittert der Diamant beim Schlag wie eine billige Glasscheibe. Das richtige
Spalten der Diamanten beherrschen nur Spezialisten (-> Webseite).
Ein falscher Schlag kann auch entsprechenden Schaden zur Folge haben. Davon berichtet der Spalter
des sagenhaften Cullinan-Diamanten, mit dem die britischen Kronjuwelen geziert wurden. Der Spalter,
der diesen großen Diamanten in immerhin 105 Teile zerlegte, war hinterher wegen der seelischen
Anstrengungen ziemlich krank.
Wie steht es aber um die chemische Stabilität eines Diamanten: Läuft ein
Diamant an der Luft an?
Ja, das sollte möglich sein. Denn er besteht ja schließlich aus reinem Kohlenstoff.
Aber seien Sie beruhigt: Man muss einen edlen Diamanten schon recht kräftig
erhitzen, damit er überhaupt zu brennen anfängt. (Anders gesagt: Man muss sehr viel
Aktivierungsenergie zuführen.) Dann aber brennt er wie Kohle (die man ja auch
aktivieren muss) und es entsteht banales Kohlenstoffdioxid.
C + O2 ———> CO2 + Energie
Zum Erproben solltet ihr aber keinesfalls den Schmuck eurer Mutter oder den "Brillie" aus dem Nasenflügel eurer Freundin aufarbeiten. (Letzterer besteht wahrscheinlich sowieso nur aus Zirkon, also aus Zirkondioxid ZrO2, das nicht brennt.)
Auf der Verbrennung eines vom französischen König gestifteten Diamanten beruhte auch der erste Nachweis seiner Zusammensetzung (um 1780 durch Lavoisier). Um die große Hitze zu erlangen, benutzte der Chemiker ein riesiges Brennglas, durch das er die Sonnenstrahlen fokussierte. Das war damals überhaupt die einzige Methode, hohe Temperaturen zu erzeugen, und die hat die Chemie ungemein beflügelt.
Bei normalen Temperaturen sind Diamanten an der Luft gegenüber chemischen Einflüssen erstaunlich haltbar. Es wird deshalb einige Millionen Jahre dauern, bis sich ihre Oxidation bemerkbar macht. Diamanten werden eher durch Umwelteinflüsse wie Wasser oder Sand erodiert. Tröstlich für Leute, die Diamantschmuck als langfristige Geldanlage horten.
Aber in dieser Zeit tritt ein anderes Problem auf. Erinnern wir uns: Man findet
Diamanten in der bekannten "blauen Erde". Das sind die Reste der Lava alter
Tiefenvulkanschlote. (Natürlich findet man sie auch in der Nähe dieser Schlote in den
Flusssedimenten.) Wie kommen die Diamanten da hinein?
Der Diamant ist eine von vielen Modifikationen des Kohlenstoffs. Die Bildung von
Modifikationen unterliegt den Gesetzen der Thermodynamik.
Der Diamant bildet sich in endothermer Reaktion durch hohen Druck und Temperatur
aus Graphit (und dieser bildete sich letztlich aus Kohle).
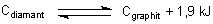
Als so genannte endotherme Substanzen sind Diamanten eher begrenzt haltbar; sie
existieren langfristig nur unter hohem Druck und hoher Temperatur. Das sind die
physikochemischen Bedingungen des Erdmantels in etwa 60 km Tiefe: Tatsächlich
liegt dort aller elementarer Kohlenstoff in der Modifikation Diamant vor. Die Edelsteine
werden durch die Aktivitäten tiefreichender Vulkane regelrecht hochgespült und in
diesem Zustand "eingefroren".
Kommt also ein Diamant in unsere "gemäßigte Welt", so müsste er sich eigentlich spontan
durch exotherme Reaktion in Graphit umwandeln. Dass er das nicht so rasch wie erwartet tut,
liegt an der außerordentlich hohen Aktivierungsenergie für diesen Prozess: Erhitzt man aber
den Diamanten längere Zeit auf über 1500 °C, führt man ihm also Aktivierungsenergie zu,
so geht er in Umkehrung der obigen schwach exothermen Reaktion in die stabilere, aber leider
auch unansehnlichere Modifikation Graphit über. Ein Diamant ist also eine
metastabile Kohlenstoffmodifikation.
Wie man Diamanten künstlich erzeugen kann
Zur Herstellung von Diamanten aus Graphit muss man "nur" die geologischen
Verhältnisse im Erdmantel nachahmen: Bei Drücken von 130000 bar und bei
Temperaturen um 3000 °C wandelt sich Graphit in Diamant um. Durch Einsatz von
Katalysatoren gelingt das auch bei weniger extremen Bedingungen. Zum Beispiel kann
man kohlenstoffreiche Nickel- oder Eisen-Metallschmelzen abkühlen. Bei deren
Kristallisation bauen sich hohe Drücke auf, in denen die in der Schmelze enthaltenen
Kohlestoffcluster zu Diamant verdichtet werden. Und damit stellt man heute schon
richtige Mehrkaräter her! (Hierin sollen die Russen wahre Meister sein.)
Weitere Texte zum Thema „Kristalle“