 |
 |
 |
 |
| Was es sonst noch so gab...
Merkwürdiges aus dem E-Mail-Korb von Professor Blume |
311 Anonym
F: Von: cl@...+
Guten Tag Herr Blume,
Ich suche ein paar Anhaltspunkte um mein Vorstellungsvermögen rund um Motoren zu erweitern. Es geht mir um die Verbrennung
im Zylinder.
Ich frage mich welcher Druck entsteht wenn ich 1ml Kraftstoff (Benzin,Diesel) mit der dazu passenden Menge Luft in einer 1Liter Flasche zünde und verbrenne. In die 1 Literflasche wurden 10 Liter luft gepumpt.d.h 10Bar Luftdruck.
Wie hoch ist der Flaschendruck nach der Verbrennung ?
Der Kraftstoff ist wie im Auto feinstzerstäubt und gleichmäßig im Brennraum verteilt.
Der Druck der entsteht ist Temperaturabhängig ?
Wie heiss ist das Gas in der Flasche wenn sie nicht explodiert ist ?
Wenn der Verschluss der Flasche bei der Explosion?Deflagration? wegfliegt und das Gas entweicht wird die Energie dann in Geschwindigkeit der Abgasmoleküle umgewandelt und nicht in Temperatur ?
Wenn die Flasche perfekt isoliert und dicht wäre könnte ich sie nach ein paar Minuten öffnen und das Abgas würde mit gleichem Druck aus der Flasche austreten wie wenn der Deckel bei der Explosion weggeflogen wäre ?
Wie hoch ist die Ausbreitungsgeschwindigkeit eines 1:15 Autokraftstoff/Luft Gemischs ?
Ich hoffe die Fragen sind nicht zu physikalisch.
Mit freundlichen Grüßen
Anonym
A: Guten Tag,
Ihr Fragenkatalog ist ja recht happig… Aber da ich weder weiß, wer Sie sind, was für Vorkenntnisse Sie haben und weshalb Sie
anfragen, möchte ich keine weitere Zeit investieren und kann Sie nur auf einschlägige Fachliteratur verweisen. Dazu gibt Ihnen
Ihre Autowerkstätte sicherlich gern Auskunft. Auch ist eine Anfrage bei Autoherstellern denkbar. Allerdings werden die garantiert
nicht antworten, wenn Sie sich wie bei mir mit „cl“ oder mit „Anonym“ vorstellen.
Mit freundlichen Grüßen
R. Blume
312 Alles verstanden, aber…
F: Ich habe mit Spannung ihren Internetinhalt gelesen und mich über die Galvanotechnik bei
ihnen informiert, da ich über dieses Thema eine Mündliche Prüfung in Chemie halten werde. Dabei möchte ich auch ein Experiment
zeigen und habe dies bereits vorher ausprobiert. Ich habe versucht einen Silberlöffel zu Verkupfern unter Stromzufluss. Dies
hat eigentlich wunderbar funktioniert, so wie ich mir das vorstellte. Es war also eine Kupferschicht am Löffel zu finden. Ich
habe den Versuch bei 8 V und 1 A durchgeführt. Jetzt habe ich leider Fragen zum genauen Ablauf. Wenn ich das richtig verstanden
habe verbinden sich die Kupferionen an der Anode mit den Sulfationen der Schwefelsäure und wandern zum Silber, wo sie sich dann
wieder trennen und sich Kupfer anlagert. Nun habe ich jedoch beobachtet, dass an der Kathode also am Silberlöffel eine Gasbildung
von statten ging, die ich mir absolut nicht erklären kann. Mir wäre es eher logischer gewesen, wenn sich an der Anode Wasserstoff
gebildet hätte, da sich ja dort die Sulfationen vom Wasserstoff der Schwefelsäure trennen. Ich hoffe sie können mir bei dem Problem
weiter helfen.
A: Ich gehe mal davon aus, dass Sie in einer schwefelsauren Lösung von Kupfersulfat einen
Kupferstab als Pluspol gegen einen Silberstab (Minuspol) geschaltet haben.
Ihre Story mit dem Verbinden von Kupfer-Ion und Sulfat-Ion ist leider nicht richtig. In Lösung liegen die immer getrennt vor. Gleiches gilt für die Schwefelsäure.
Das Cu2+-Ion wandert natürlich ohne Bindung an das Sulfat-Ion zur Silberkathode. Der Trick der galvanischen Verkupferung ist ja gerade, dass das Ion aufgrund seiner positiven Ladung zum negativen Pol gezogen wird! An das Sulfat gebunden könnte es ja gar nicht wandern, weil diese „Verbindung“ nach außen hin elektrisch neutral ist.
An der Kathode findet neben der Entladung der Cu-Ionen zugleich auch eine Entladung von Protonen statt, wobei Wasserstoff entsteht. Die Reaktion ist
2 H+ + 2 e- -> H2
Wieso das an der Anode ablaufen sollte, ist mir unverständlich. Denn die Protonen können kaum an den positiv geladenen Pol gezogen werden. Da bildet sich aus Wasser Sauerstoff, wobei die sich dort ansammelnden negativ geladenen Sulfat-Ionen als Katalysatoren wirken.
Mein Tipp: Schauen Sie sich vor der Prüfung die Theorie der Galvanik noch einmal genau an…
313 Betreff: Baustoff Holz
F: Hallo ,mein Name ist … und ich soll in Chemie Unterricht einen Vortrag zum Tema Holz
also Baustoff und wollte fragen welche Holzarten und warum sie zum bauen von Häusern benutzt werden?
ich würde mich auf eine Antwort freuen
Lg …
A: Liebe …,
leider bin ich da als Chemiker überfordert. Ich weiß zwar einiges dazu, aber das ist eher Allgemeinwissen, wie es vielleicht auch
dein Vater oder dein Opa hat. An deiner Stelle würde ich einen Zimmermann oder Tischler befragen.
314 Totgebrannter Kalk
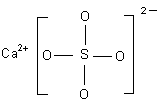
F: Wir nehmen gerade das Thema Kalk im Unterricht durch und wollen die Strukturformel von
totgebranntem Kalk (CaSO4) finden. Können Sie uns da weiterhelfen?
A: Wie immer weiß ich nicht, was ihr schon wisst…
Was ihr da habt, ist totgebrannter Gips: CaSO4. Kalk hat die Formel CaCO3 und kann nicht totgebrannt werden. Ich vermute, du meinst wirklich Gips.
Totgebrannter Gips ist Calciumsulfat. Dieses Salz besteht eigentlich aus zwei Teilen, dem Calciumanteil (positiv geladen) und dem Sulfatanteil (negativ geladen). Zwischen den beiden gibt es also keine direkte Bindung, sondern sie ziehen sich an wie ein Magnet den anderen. Diese Teile nennt man Ionen.
Hier ist die Formel.
315 Referat über Ascorbinsäure
F1: Guten Herr Blume,
unsere Chemielehrerin nimmt für ihren Unterricht immer ihre Vorlagen. Deshalb wollte ich Sie einmal fragen, ob Sie mir vielleicht
eine Präsentation oder einen Vortrag über Ascorbinsäure senden könnten ?
Vielen Dank,
mit freundlichen Grüßen,
A1: Die Präsentation müssen Sie sich schon selbst zusammenstellen. Z. B. anhand meiner
Webseitengruppe „Die Chemie der Ascorbinsäure“.
F2: Vielen Dank für den Link! Ich wusste nur nicht, wie ich zu ihren Informationen direkt komme.