 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
891
F: Folgende Frage ergab sich aus einem Gespräch mit einem Vereinsmitglied: er
hatte festgestellt, dass beim Händewaschen mit Seife die Hände sauberer werden, wenn er Gebirgswasser, also Wasser
direkt aus einem Gebirgsbach verwendet. Mit Wasser aus dem herkömmlichen Haushalt hingegen würden die Hände,
ebenfalls mit der gleichen Seife verwendet, lange nicht so sauber werden. Ich versprach ihm, dem nachzugehen,
konnte aber bisher keine Erklärung finden. Ihm war es wichtig zu wissen, warum der Effekt auftritt, wenn ihr bei
beiden dieselbe Seifensorte verwendet.
Hätten Sie bitte vielleicht eine Erklärung für dieses Phänomen? Ich selber habe nur die Vermutung, dass es mit
der Wasserhärte, also dem ph-Wert, zusammenhängen muss.
A: Ich gehe davon aus, dass Ihr Freund ein klassisches Gebirge aus Granit
und anderen Silicaten meint. Bei den Kalkstein-Alpen oder den Dolomiten (bestehend aus Dolomit, einem Mischcarbonat
von Magnesium und Calcium) wäre die Argumentation entgegengesetzt!
Zuvor ist wichtig zu wissen: Seifen sind Natrium- bzw. Kaliumsalze von langkettigen Fettsäuren. Sie sind in
Wasser löslich und bilden Tenside, die Fett emulgieren und Schmutz einschließen. Außerdem sorgen sie durch Hydrolyse
für alkalisches Milieu, das zusätzlich zum Fettabbau beiträgt.
Ca- und Mg-Ionen reagieren mit den Seifenanionen und bilden schwerlösliche Niederschläge ("Kalkseifen"). Damit
werden die Seifen-Anionen den grundlegenden Tensidreaktionen entzogen.
Granit ist sehr schlecht wasserlöslich und das Wasser, das damit Kontakt hat, ist sehr weich - wie Grundwasser
aus Sandschichten - wie etwa in der Senne. Es ist extrem arm an Ca- und Mg-Ionen.
Ihr Freund hat also Recht.
Lesen Sie unsere Webseiten zur Wasserhärte.
892
F: Herzlichen Glückwunsch zu Ihrer gelungenen Internetseite. So macht Chemie
doch Spaß. Mein Anliegen ist folgendes:
Frage meines Dozenten: Ist Formaldehyd in Wasser löslich?
Ich: Ja, wegen polarer Bindung, Wasserstoffbrücken etc.
Dozent: Ich sage ihnen aber dass Formaldehyd nicht in Waser löslich ist, jedenfalls nicht nach dieser Theorie.
Trotzdem kann man 30% Formalinlösung kaufen. Wie ist da möglich?
Können sie ir in dieser Sache vielleicht weiterhelfen?
Vielen Dank schon mal im Voraus für Ihre Mühen
A: Formaldehyd HCHO bildet in wässriger Lösung durch Addition Hydrate und
liegt zum großen Teil im Gleichgewicht als HO-CH2-OH vor.
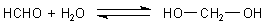
Das widerspricht zwar der Hansschen Regel, nach der nicht mehr als eine OH-Gruppe an einem C-Atom fixiert sein kann.
Aber hier wirken die H-Atome und das O-Atom so stark Elektronen ziehend, dass das C-Atom ausreichend positiv
polarisiert ist. Dann kann sich ein H2O-Molekül anlagern.
Das alles hätten Sie aber auch selbst in einem Lehrbuch zur Organischen Chemie nachlesen können - wie z. B.
im "Hans Beyer". Also bitte erst blättern, dann fragen...
893
F: Betreff: Hilfe bei oxidationszahl von methanal!!!!
Hallo herr blume,
Können sie mir bitte die oxidationszahlen von methanal angeben,
Vielen dank, sanne
A: Methanal ist HCHO. Die Gesamt-Oxidationszahl des Moleküls ist 0 (Null).
Genau:
OZ von C Null
OZ von O -II
OZ von H 2 · (+1)
Summe: 0-2+2 = 0
F: hallo, nochmals vielen dank! war mir nich sicher, ob ein element auch
in einer verbindung null haben kann.
A: Überrascht? Rechnen Sie mal die Oxidationszahl der C-Atome in der
Glucose aus! Daher (das heißt aus den Ergebnissen der Elementaranalyse) stammt übrigens die erste Theorie
bezüglich der Glucosezusammensetzung: Das sei schlichter Hexaformaldehyd!
6 (HCHO) ———> C6H12O6
894
F: Als die Schüler vor kurzem im Anfangsunterricht die Wasserlöslichkeit
verschiedener Stoffe testen sollten, fiel ihnen auf (was mich in Erklärungsnot brachte), dass sich bei der
Zugabe von Aktivkohlekörnchen zu Wasser Gasbläschen bilden. Ich gehe davon aus, dass es sich nicht um eine
Reaktion handelt, sondern eher, dass gelöste Gase entweichen. Theoretisch würde ich aufgrund der großen
Oberfläche der Aktivkohle aber eher das Gegenteil, also eine Adsorption, erwarten....
Was meinen Sie dazu ?
A: Ganz klar: Es handelt sich um adsorbierte Luft-Gase! Bei einer
Aktivkohletablette schäumt das Ganze sogar kräftig auf und man hört die entweichende Luft richtig zischen!
Die Luftmoleküle sind unpolar und werden von der ebenfalls unpolaren Aktivkohle stark adsorbiert. Bindungstyp:
London-van der Waals-Wechselwirkungen. Gibt man Wasser hinzu, kommt es zur Konkurrenz um die Bindungsstellen.
Wasser ist dann ja im totalen Überschuß vorhanden. Denn auch Wasser ist "van der Waals-aktiv". Hinzu kommt, dass
Wasser selbst Gase in käfigartigen Strukturen einkapselt und deshalb zu lösen vermag und diese auch leicht wieder
abgibt.
Schauen Sie in meine Webseitengruppe "Wasser und Leben", da
steht einiges zu der Löslichkeit der Gase.
895
F: Sehr geschätzte Mitarbeiter des Prof. Blume Teams,
ich habe im Internet bereits viel über Ihre Versuche gelesen nun habe ich eine Frage an Sie : ist
es möglich ;eine Reduktionslösung für Silber zu analysieren ??
A: Jede Substanzmischung ist analysierbar. Das ist aber nicht
so ganz billig... Ich empfehle deshalb eine Anfrage an den Hersteller der Lösung - falls Sie gesundheitliche
Probleme damit haben, wird er Ihnen sicherlich antworten (müssen).