 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1211
F: Was ist "Golden Rice"?
A: Das ist eine Reissorte, die gelbe Körner bildet. Sie ist das
Produkt einer Genmanipulation. Man hat in das Genom zusätzlich zwei Gene eingebaut, aufgrund deren die
Reispflanze mehr b-Carotin produziert. Das wirkt sich so aus, dass auch das Reiskorn
mehr von dem gelbroten Farbstoff einlagert. b-Carotin ist übrigens Provitamin A.
1212
F: Ich bzw. meine Schüler haben mal wieder ein Problem. Im Unterricht haben wir
die Gleichung von Nernst für Metallsalzlösungen hergeleitet.
Aus Sicht der Schüler wäre es jedoch logisch sinnvoller, wenn hier nicht durch die Elektronenzahl dividiert sondern
mit ihr multipliziert würde. Ihr Argument: Je mehr Elektronen ein Stoff liefert, desto stärker sollte die Auswirkung auf
das Potential sein ("Proportionalität"). Dies kann ich nachvollziehen. Jetzt möchten sie von mir eine logische Begründung
für die "Antiproportionaltität". Diese kann ich und meine Kollegen Ihnen nicht liefern. Haben Sie eine Idee oder müssen
die Schüler diesen Sachverhalt einfach akzeptieren?
A: Das ist eine gute Frage, die eigentlich eher die Physikkollegen angeht.
Gehen wir erst einmal ganz formal vor. Bei der Herleitung der Nernstschen Gleichung geht man vom chemischen Potential aus, also von einer Energie. Für die elektrische Energie gilt:
E = U · I · t
I · t ist Ladung.
Die Spannung ist dann:
U = E / Ladung
Nun setzen wir für die Ladung den Wert der Elementarladung. Molar betrachtet ist das die Faraday-Konstante F, multipliziert mit dem Mol-Faktor n.
U = E / n · F
Wenn bei einem Redoxprozess viel Ladung ausgetauscht wird, wird auch mehr chemische Energie umgesetzt.
Bei fester, gegebener Energie nimmt allerdings die Spannung mit zunehmender Ladungsübertragung ab.
Das sollte fürs Erste reichen. Man kann es aber auch so sagen:
Es gibt eine Standard-Energie (ausgedrückt durch G0 bzw. durch das Standardpotential E0), die für den Gleichgewichtszustand gilt. Der Wert dieser Energie kann bei konstantem n im Wert durch Konzentrationsänderungen im stofflichen Redoxsystem beeinflusst werden.
Wenn ein Mol von (n+)-Ionen sich auf der Metallelektrode niederschlägt, entzieht es diesem n Mol Elektronen; das Potential der Elektrode steigt an.
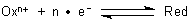
Die Potentialsteigerung erfolgt aber nicht linear mit der Konzentration! Was das Ganze kompliziert, ist, dass die Nernstsche Gleichung hinsichtlich der Konzentrationen ein logarithmischer Ausdruck (bekannt aus dem MWG) ist. Nennen wir diesen Konzentrationsquotienten Q.
Q = [Ox] / [Red]
Wir können das Gleichgewicht
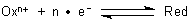
auch umschreiben, um alles auf die Gesamtmenge von 1 Mol ausgetauschter Elektronen zu beziehen.
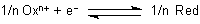
(Früher nannte man das alles ein Val. Das stand für Mol/Wertigkeit oder Mol/übertragene Elektronen. Das war irgendwie viel einfacher. So war 1 Val KMnO4 1/5 Mol. Statt von molaren Lösungen sprach man von normalen Lösungen.)
Daraus folgt
log Q = log [Ox]1/n / [Red]1/n
1/n · log Q = log [Ox] / [Red]
F: Herzlichen Dank für Ihre Erklärung, die ich verstanden habe und so an die
Schüler weitergeben werde.
Der Schüler, der diese Fragestellung einreichte, hat Physikleistungskurs und ist auch sonst naturwissenschaftlich
sehr fit. Die mathematische Herleitung wird ihm und den meisten anderen Schülern des Kurses wohl keine Probleme
bereiten. Rein intuitiv wollten sie zwar eine anschauliche Erklärung, die es dann wohl nicht gibt.
Bis zur nächsten Frage aus diesem guten, interessierten Chemiegrundkurs, der mich mit seinen Ideen und Fragestellungen immer wieder verblüfft..-
1213
F: Betreff: Experiment zum Homogenisieren von Milch
Guten Tag Herr Prof. Blumes!
Ich bin eine Schülerin eines Schweizer Gymnasiums in Basel. Ich bin nun in der 11. Klasse und in Chemie machen
wir eine Abschlussarbeit in 3-er Gruppen.
Meine Gruppe und ich untersuchen die Milch etwas näher. Wir haben Kontakt zu Bauern und können somit auch frische Milch(direkt von der Kuh) "bearbeiten".
Wir würden gerne ihr Experiment "Modellversuch zur Simulation des Homogenisiervorgangs" durchführen. Jedoch würden wir es gerne mit frischer Milch durchführen, statt mit Speiseöl. Meine Frage ist, ob ihr Versuch auf ihrer Internetseite auch auf die Milch übertragbar ist, und wenn nicht, ob sie uns eine Durchführungsvorschrift eines solchen Versuchs hätten.
A: Das Prinzip der Homogenisierung von Milch kann man mit Fett/Wasser-Mischungen
zeigen. Deshalb haben wir den von euch angesprochenen Modell-Versuch im Angebot, mit dem man lernen kann, wie das prinzipiell
geht. Statt zu schütteln könnt Ihr auch ein Ultraschallbad nutzen.
Nun zur Milch: Ihr wollt eine noch feinere Emulsion als die natürliche Milch herstellen. Im Hintergrundtext steht zum technischen Verfahren der Milchhomogenisierung:
"Die Rohmilch wird bei einem Druck von 200 bar durch feinste Düsen gepresst, wodurch die Fetttröpfchen auf etwa ein Fünftel ihrer Größe zerschlagen werden. Nach dieser Prozedur liegen zwar kleinere, aber dafür sehr viel mehr Fettpartikel in der Flüssigkeit vor, wodurch die Fettoberfläche insgesamt vergrößert wird. Auch das Milcheiweiß liegt nach dem Homogenisieren in feinerer Form vor."
Wie wollt ihr etwas homogenisieren, was schon homogen ist? Milch ist bereits eine Emulsion!!! Ich glaube nicht, dass ihr dieses Verfahren zur Verfeinerung einer Emulsion im Schulversuch so einfach nachahmen könnt. Auch hier könntet ihr es mit einem Ultraschallbad versuchen. Aber wie wollt ihr überhaupt beweisen, dass eure Homogenisierung Erfolg hatte? Dazu benötigt ihr spezielle optische Geräte.
1214
F: Ich bin Referendar in Stuttgart und bekomme am Freitag Unterrichtsbesuch von
meiner Fachleiterin. In dieser Stunde möchte ich u.a. das Überhitzung von Fetten behandeln. Dazu habe ich folgende Frage
an Sie: Wenn man ein Fett stark erhitzt (beispielsweise in der Pfanne), ohne ein Lebensmittel dazuzugeben, entsteht
Glycerin, das zu Acrolein weiterreagiert. Wie kann aber das Glycerin aus dem Fett entstehen, wenn kein Wasser (zur
Hydrolyse) dazugegeben wird? In allen Büchern dazu habe ich keine Antwort gefunden und auch meine Mentorin weiß keine
Antwort. Können Sie mir helfen?
A: Mein Tipp: Versuchen Sie nicht, Ihren Schülern etwas derartig Vielfältiges
zu erklären, was zu viele ungesicherte Reaktionsmöglichkeiten aufweist. Vor allem machen Sie dabei bitte keine
Einschränkungen hinsichtlich der Zusammensetzung des Fetts: Zunächst einmal gibt es kein natürliches Fett ohne
Wassergehalt. Außerdem können Sie den Einfluss des Sauerstoffs nicht ausschließen.
Bedenken Sie, dass die Reaktion auch beim Glycerin nicht so einheitlich abläuft, wie sie im Lehrbuch beschrieben steht. Es handelt sich hier um vielfältige radikalische Prozesse, über die man deshalb in der Literatur wenig findet.
Zunächst wird wohl bei C1 und C2 des Glyceringerüsts je ein R-COO·-Radikal
abspalten, die zu R· und CO2 weiterreagieren. Im Glycerin entsteht dann eine Doppelbindung.
Die Radikale reichern sich im Fett an und führen irgendwann einmal zur Selbstentzündung.
Beim dritten C-Atom kann zum Beispiel unter Bildung einer Aldehydfunktion ein R-CHO abgespalten werden, so dass letztlich
unter Einwirkung von Sauerstoff auch ein R-COO· ´rausfliegt.