 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1251
F: Ich habe einige Ihrer Citronensäureversuche praktisch nachvollzogen
und alle sind hervorragend verlaufen.
Aus diesem Grund: Herzlichen Dank für die Anleitungen sowie die dazugehörigen Hintergrundinformationen.
Auch die Isolation der Citronensäure verlief problemlos, mich würde jedoch die Funktion der Ammoniaklösung
interessieren und wieso die alleinige Zugabe von Calciumchlorid nicht ausreicht, um nach dem Erhitzen Calciumcitrat
zu erhalten. Wäre der Grund die Änderung des pH-Wertes ins Alkalische, spräche dann etwas gegen Kalkwasser anstelle
von Ammoniaklösung + Calciumchlorid?
A: Die Citronensäure (CS) muss vollständig dissoziiert sein, um mit
den Ca-Ionen quantitativ reagieren zu können. Außerdem müssen ausreichend Ca2+-Ionen zur Verfügung stehen. Bei
Zusatz von Kalkwasser ist das wegen der geringen Löslichkeit von Ca(OH)2 nicht gewährleistet. Der pH-Wert würde
zwar stimmen, aber die Konzentration von Ca-Ionen wäre viel zu gering. Stichwort: Löslichkeitsprodukt.
Man könnte zum Alkalisieren auch Natronlauge nehmen - aber dann ständen die Natrium-Ionen in Konkurrenz zu den Calcium-Ionen; es blieben zu viele Citrat-Anionen in Lösung.
Ein weiterer Vorteil von Ammoniakzusatz: Beim Erhitzen zur Bildung von Ca-Citrat wird NH3 zum Teil ausgetrieben.
1252
F: Habe mit großem Interesse Ihre Seite/Versuche zum weißen Phosphor gelesen!
Vor vielen Jahren hatte ich auch einmal das Vergnügen mit dieser bemerkenswerten Substanz zu arbeiten.
Im Zuge einer eventuellen Experimentalvorlesung / Harry-Potter-Event denke ich wieder über so etwas nach -
aber- im Gegensatz zu früher vertreibt niemand mehr weißen Phosphor?!
Damals gab es noch von Merck Darmstadt 100g Packungen (nach DAB 6, welches aber schon lange außer Kraft ist). Fluka.
Sigma, Merck, Lancaster, Aldrich - nirgends konnte ich welchen finden?
Habe ich da etwas übersehen oder muss man ihn heute selbst destillieren?
A: Weißen/gelben Phosphor können Sie leider nicht mehr kaufen. Selbst die
Forscher, die damit arbeiten, müssen ihn sich selbst aus rotem Phosphor herstellen. Mit der Destillation (unter
Luftabschluss!) liegen Sie nicht ganz falsch. Aber vielleicht hat ja noch ein alter Lehrer einen Vorrat…
1253
F: Frage: Wird bei der Denaturierung von Eiweiss mit Säuren oder Laugen die
Primärstruktur des Proteins durch Hydrolyse der Peptidbindungen zerstört?
A: Antwort: Nein.
1254
F: Betreff: eine farbige frage
Ich glaube ich sitze auf dem Schlauch... trotz intensiver Recherche ist es mir nicht gelungen eine eindeutige
Antwort auf die Frage zu finden, ob Rote Beete-Saft (also das Betanin) ein Indikator ist - so wie der Rotkohlsaft
(also das Cyanidin). Und dann wüsste ich natürlich auch gerne warum :-)
Die Intention dahinter: Ich habe mich gefragt warum in Lebensmitteln immer Rote Beete-Saft zum Färben genommen
wird, aber nicht Rotkohlsaft. Eine mögliche Erklärung wäre ja, dass sich Rotkohlsaft im Gegensatz zu Betanin verfärben
würde.
Können Sie mir helfen? Das wäre prima!
Herzliche Grüße...
A: Säure/Base-Indikatoren sind solche Stoffe, die als Folge von Protonierung
oder Protonenabspaltung Farbunterschiede zeigen.
Jungchemiker müssen zunächst das mesomere farbgebende System ausmachen. Hier reicht es vom Benzol-Ring (1) über ein Trien bis Ring (3). Dieser große Chromophor enthält ein p-Elektronensystem, das leicht anregbar ist. Daher kommt eine Grundfärbung: Betanin absorbiert Blaugrün; der Farbstoff ist also rot.
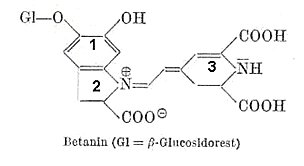
Anschließend muss man sich überlegen, wie Betanin bei der Einwirkung von Säuren oder Laugen reagieren könnte.
1) Im alkalischen Milieu ist die Dissoziation der Carboxylgruppen möglich. Sie wirkt sich aber nicht farbvertiefend
aus. Das ist ähnlich wie bei den -SO3- -Gruppen, die ausschließlich zur Erhöhung der Löslichkeit
in künstliche Farbstoffe eingebaut werden.
Man könnte über die Dissoziation der phenolischen OH-Gruppe an Ring (1) spekulieren. Das (+)-geladene N-Atom im Fünfring
(2) kann ja schließlich elektronenanziehend wirken. Dann kommt aber das N im Ring (3); hier kommt es zu einem Elektronenstau.
2) Im sauren Milieu kann es zur Protonierung der basischen NH-Funktion im (nicht aromatischen) Ring (3) kommen. Die bringt auch nichts, denn es folgt kein Elektronennachschub, weil das Phenol in (1) im Sauren nicht dissoziiert ist.
Also ist Betanin kein Säure/Base-Indikator. Damit ist Betanin stabil gegenüber Säuren und Basen. Deshalb kann man mit ihm färben. Das gilt nicht für den Rotkohlfarbstoff, den man ja gern als Indikator nimmt. Stellen Sie sich vor: Sie haben eine Klamotte, die beim Waschen in der Lauge grün bis gelb wird und die beim Bekleckern mit Citronensaft rot anläuft. Hinzu kommt, dass es einen mittleren pH-Bereich (um 5) gibt, bei dem sich die Rotkohlfarbstoffe unter Wasseranlagerung entfärben.
1255
F: In Ihren Seiten habe ich unter Anderem von Amygdalin gelesen.
Mir ist es aus der Medizin als Laetril oder Vitamin B17 bekannt.
Wenn Sie die Zeit finden würden, wäre es nett, mir Infos zur chem. Zusammensetzung und zum Reaktionsvermögen
des Stoffes zu übersenden; und wenn möglich, einen Nachweis.
Leider habe ich nie viel zur Chemie von Amygdalin finden können, nur dass es in den USA verboten ist, da
einige Ärzte meinen, Krebs damit behandeln zu können, was sich in der Literatur, die ich dazu fand, medizinisch
gesehen gar nicht abwegig anhört!?
Schauen Sie doch bei Gelegenheit mal in das Buch "Eine Welt ohne Krebs" von G.Edward Griffin (Kopp-Verlag).
Das hab ich bei einer befreundeten Krankenschwester geliehen
(Die hat u. a. auf der Krebsstation gearbeitet).
A: Dazu haben wir einen Tipp des Monats April 2006 "Chemie mit dem
Kirschlorbeer"
Da finden Sie alles. Es handelt sich keineswegs um ein Vitamin oder Pseudovitamin, sondern um ein Gift,
das im Körper Blausäure freisetzt. Es wurde versucht, mit diesem Krebs zu bekämpfen. Diese Methode ist aber
wegen der vielen Nebenwirkungen verboten. Deshalb darf Amygdalin auch nicht von Apotheken abgegeben werden.
Nichtsdestotrotz kommt es immer wieder ins Gespräch. Es gibt sicherlich obskure Quellen, von denen man es
beziehen kann. Seien Sie vorsichtig, auch bei entsprechenden Büchern und anderem esoterischen Quatsch.
Ernähren Sie sich gesund - dann bleiben Sie es auch - bis Sie hoffentlich gesund sterben... Essen Sie jeden Tag ein-zwei Äpfel. Das reicht.