 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1321
F: Proteine oder Stärke sind doch aufgrund ihrer Molekülgröße
osmotisch inaktiv. Gibt es dann eine Definition der osmotischen Aktivität anhand der Molekülgröße,
dass man sagt:
ab so und soviel Dalton ist ein Stoff nicht mehr osmotisch aktiv?
A: Der osmotische Druck baut sich auf, wenn Sie einen Raum
mit gelösten Stoffen über eine halbdurchlässige Membran mit einem zweiten Raum verbinden, der mit Reinwasser
oder mit einer weniger konzentrierten Lösung angefüllt ist. Die Membran ist nur für Wassermoleküle
durchlässig. Der Raum mit der höher konzentrierten Lösung zieht Wasser zu sich herüber. Dahinter
steckt die Tendenz der konzentrierteren Lösung, sich auf Kosten der anderen zu verdünnen - letztlich
ein Entropieeffekt. Bei den osmotischen Effekten geht es ursächlich um die Konkurrenz um das Lösungs-
und Hydratationswasser.
Der osmotische Druck ist (zumindest in nicht zu konzentrierten Lösungen) eine direkte Funktion der Teilchenzahl, ist also der Konzentration des gelösten Stoffs in mol/l direkt proportional. (Statt Konzentration verwendet man besser die Aktivität.) Wir sprechen übrigens von einer kolligativen Eigenschaft. (Ähnliches beobachten wir bei der Gefrierpunktserniedrigung oder bei der Siedepunktserhöhung. Solche Eigenschaften können wir umgekehrt nutzen, um die Molmasse der gelösten Stoffe zu ermitteln.)
F: Bedeutet das dann, dass auch Makromoleküle wie Proteine
und Stärke zu einem gewissen Grad osmotisch aktiv sind, nur eben nicht so sehr wie ihre Bruchstücke,
die Aminosäuren und die Einfachzucker? Ich hatte bisher die Vorstellung, dass Proteine und Stärke gar
nicht osmotisch aktiv sind.
A: Alles, was irgendwie mit Wasser Hydrathüllen bildet,
ist osmotisch aktiv. So tragen beide, Aminosäuremoleküle und Proteinmoleküle, viele polare Gruppen,
an denen Wassermoleküle andocken können. Viele kleine Aminosäuremoleküle erzeugen jedoch einen höheren
osmotischen Druck als ein großes Proteinmolekül, weil um sie herum mehr Wassermoleküle Platz finden
als an einem großen Proteinmolekül. Deshalb ziehen sie mehr Wassermoleküle durch die Membran. Analoges
beobachten wir bei Kohlenhydraten - wie Glucose und Stärke (etc.).
Das Ergebnis ist nur eine Frage der Größenordnung der Effekte! Für Ihre Messungen können Sie vielleicht
die Minieffekte der Makromoleküle vergessen. Das müssen Sie hinsichtlich Ihrer Messmethoden abschätzen
- Stichwort: Fehleranalyse.
1322
F: Betreff: SnF2 in Zahnpasta - HF-Freisetzung?
Ich las gerade den Artikel "Wie Säuren Zähne gefährden und was man dagegen tun kann",
und habe eine Frage dazu:
Sie schreiben, dass man manchmal liest, dass Meridol-Zahnpasta SnF2 enthält. Im Kontakt
mit Wasser fällt schwerlösliches SnO aus, das Haarrisse im Zahn kittet.
Müsste aber nach folgender Reaktion nicht auch gleichzeitig Fluorwasserstoff entstehen,
und was passiert damit?
SnF2 + H2O --> SnO + 2 HF
Bitte klären Sie mich auf.
P.S.: Bin Chemie-Student im ersten Semester. Also nicht wirklich versiert, kenne aber die Grundlagen.
A: Ihre Reaktionsgleichung ist richtig. Aber Sie müssen
eine Reaktionsumgebung berücksichtigen, die man nicht allein nur mit H2O beschreiben kann.
Stichwort für Sie: Systemerweiterung. Der Speichel ist ein stark gepuffertes Reaktionsmedium mit
alkalischem Milieu. Das unterstützt nicht nur die Hydrolyse des SnF2. Hinzu kommt: Statt
hochtoxischem HF entstehen Fluorid-Ionen. Die können direkt zur Kariesprophylaxe in den Zahnschmelz
eingebaut werden. Stichwort: Fluoridierung.
1323
F: Woher und wie kommt der Zucker in der Möhre und welche
Bedeutung hat er für die Pflanze?
Meine Vermutung: Die Möhre baut den Zucker bei der Fotosynthese auf und verbraucht ihn teilweise,
um zu wachsen... Ich vermute, dass es so ist wie bei Fotosynthese/Zellatmung des Blattes:
Tagsüber betreibt die Pflanze Fotosynthese, um die Lebensvorgänge in ihren Zellen aufrecht zu
erhalten und neue Stoffe aufzubauen. Bei der Fotosynthese werden Kohlenstoffdioxid (CO2) und Wasser
verbraucht und Sauerstoff und Glucose (Zucker, Stärke) gebildet. Die Pflanze wächst nicht, weil sie
nur das CO2 verbrauchen kann, was sie nachts gebildet hat.
Nachts atmet die Pflanze. Die aufgebauten, energiereichen Stoffe zur Energieumwandlung werden
abgebaut, die Pflanze wächst. Dabei verbraucht sie Kohlenhydrate, also u.a. den Zucker, den sie
tagsüber aufgebaut hat.
Haben Sie noch eine andere Idee? Möglicherweise hat der Zucker auch noch etwas mit der Früh- und
Späternte der Möhren zutun, da die Lichtenergie ja unterschiedlich ist... aber ganz sicher bin ich
mir nicht.
Ich bin gespannt auf Ihre Antwort, beste Grüße, ..., 13 Jahre
A: Die Fotosynthese hast du richtig beschrieben. Die
Pflanze nutzt jedoch nicht alle Zuckermoleküle zum oberirdischen Stängel- und Blattaufbau, sondern
schickt einen Teil der gebildeten Verbindungen in die Wurzel, um deren Aufbau voranzutreiben.
Diese orangefarbene "Möhre" ist nämlich ihre Lebensgrundlage für Mangelzeiten und für den Winter.
Möhren sind zweijährige Pflanzen - wie zum Beispiel auch die Stockrosen. Aus dieser Wurzel heraus
bildet sie im zweiten Jahr die für die Vermehrung wichtige blüten- und fruchtbildende oberirdische
Pflanze.
Noch etwas zu deiner Aussage: "Die Pflanze wächst nicht, weil sie nur das CO2 verbrauchen
kann, was sie nachts durch ihre Atmung gebildet hat." Das gilt nur in geschlossenen Räumen, wenn man
die Pflanze in eine Retorte sperren würde, die nur Licht durchlässt. Normalerweise wächst die Pflanze
in der offenen Natur auch am Tag, weil das Angebot an CO2 mehr als ausreichend ist.
F: Hallo Prof. Dr. Blume, das hört sich absolut logisch an...
dass auch das CO2 mehr als ausreichend vorhanden ist. An den Wintervorrat habe ich nicht gedacht...
natürlich, sie "lebt" ja auch ohne das Grün weiter, auch wenn sie geerntet ist. Schade, dass Sie nicht
an unserer Schule unterrichten! Vielen Dank für Ihre Hilfe - das war wie immer KLASSE! Ihre ...
1324
F: Lieber Herr Prof. Blume,
Wenn man Kaliumnitrat bei Zimmertemperatur in Wasser lösen möchte bleibt ein Bodensatz. Wenn man
es erwärmt löst sich dieser vollständig auf. Wie kommt dies zustande?
A: Die Löslichkeit ist eine Frage der Temperatur. Zum Verstehen
musst du dir klar machen, was beim Lösen eines Salzes passiert: Die Teilchen (Moleküle) des Wassers stoßen
an den Kristall und lösen die Teilchen, die den Kristall aufbauen, heraus. (Beim Salz sind das Ionen, beim
Zucker Moleküle.) Die Wassermoleküle umhüllen diese Kristallteilchen und transportieren sie weg. Je wärmer
die Lösung ist, desto mehr bewegen sich die Wasserteilchen, und desto effektiver können sie den Kristall
zerstören.
Das Ganze hat zur Folge, dass die Lösung abkühlt, denn der Vorgang verbraucht Energie. Oder anders gesagt:
Die Wasserteilchen werden langsamer und weniger aktiv.
Wenn wir das Ganze erwärmen, bekommen die Wassermoleküle wieder mehr Energie, bewegen sich schneller und können auch die restlichen Kristalle zerlegen. Das geht aber nur bis zu einer bestimmten Grenze: Wenn die Wassermoleküle nicht mehr ausreichen, um alle Kristallteilchen zu umhüllen und abzutransportieren, bleibt ein ungelöster Bodensatz zurück. Wir sprechen in diesem Fall von einer gesättigten Lösung.
Das Ganze kannst du zu Hause auch selbst ausprobieren. Nimm aber ein Speisesalz, was sich wirklich löst. Unser Kochsalz enthält meistens Zusätze, die sich nicht vollständig lösen! Probier es auch mal mit Zucker.
1325
F: Da wir in der letzten Unterrichtsstunde auf das Thema Mesomerie
bei Peptidbindung kamen und ich meinem Lehrer eine Frage stellte, die sich um das Energieniveau bei Peptidbindung
handelte, welche dieser mir nicht beantworten konnte, wende ich mich jetzt an sie, um meinem Lehrer die Antwort
präsentieren zu können:
Warum verbindet sich nicht das Wasserstoffproton mit dem negativ geladenen Sauerstoff Atom und gleicht damit
das sturkturenergetische Niveau auf einfache Art und Weise aus, ohne dass das Molekül sich ständig unter
Delokalisation von Elektronen im planaren Zustand halten muss. Energetisch wäre diese Form ebenso ausgeglichen
und damit Stabil, wie auch bei der Delokalisierung, wobei meine These natürlich auch falsch seien kann.
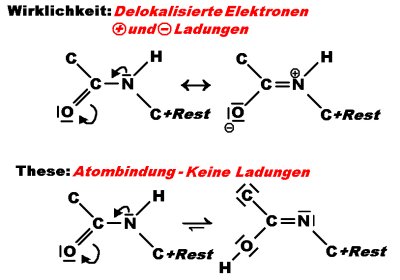
Ich bin mir im klaren, dass die planare Form schon nachgewiesen wurde und damit die freie Drehbarkeit ausgeschlossen ist, allerdings würde es mich sehr interessieren, warum das oben beschriebene nicht der Wirklichkeit entspricht.
A: Sie vergleichen eine chemische Keto-Enol-Tautomerie (unten)
mit einer physikalischen Mesomerie (oben).
Zu Ihrer Frage, was denn richtiger sei: Stickstoff ist weniger elektronegativ als Sauerstoff. N gibt
somit seine Elektronen eher ab als O. N ist damit so basisch, dass sich seine Atome eher mit dem Wasserstoffatom
verbinden als es der Sauerstoff tut. Es behält sein Wasserstoffatom somit bei sich. Übrigens können Sie die
unterschiedliche Basizität von N und O erkennen, wenn Sie die Protonierungsbedingungen von NH3 und
von H2O vergleichen: Zur Bildung von H3O+ ist ein viel höherer Protonendruck
(= niedrigerer pH-Wert) nötig als zur Bildung von NH4+.
Hinzu kommt, dass die "wirkliche" Struktur symmetrischer ist als die Ihrer "These". Auch das senkt die potentielle Energie des Systems.
F: Vielen Dank für Ihre so schnelle Antwort und vielen Dank dafür,
dass Sie mir in meiner Frage geholfen haben.
Ich hoffe, wir sehen uns irgendwann in Zukunft einmal in einer Ihrer Vorlesungen.
A: Ihre Mails haben mich gefreut und es machte Spaß, sie zu
beantworten. Mit dem Treffen in den Vorlesungen wird´s leider nichts mehr: Ich scheide Ende Februar ohne
"Wenn und Aber" aus dem Dienst aus. Übrigens: Mein Server wird Ihnen erhalten bleiben.
F: Wenn das so ist, dann können sie sich ja schonmal auf mehr
Post von mir freuen, wenn ich denn einmal soweit bin und mit dem Studium beginnen kann. =)
*War natürlich ein Scherz*
Ich probiere es zu vermeiden etwas nicht zu verstehen, allerdings bei eigenen Einfällen und Überlegungen
wird meine eigene Kompetenz nicht immer ausreichen. : )
A: Es ist immer gut, wenn Sie Fragen stellen. Neugierde ist die
Voraussetzung für eine gute wissenschaftliche Laufbahn... Dazu muss noch eine gesunde Portion Spieltrieb
kommen.
Viel Erfolg dazu!