 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1336
F: Bei den Tipps des Monats haben Sie geschrieben, dass Eosin auch
dann seine rote Farbe behält, wenn das zentrale C-Atom sp3 hybridisiert ist, da der Elektronenaustausch
zwischen den Phenolen über die Sauerstoffbrücke erfolge. Es ist mir klar, dass die freien Elektronenpaare
der Sauerstoffbrücke in die Grenzstrukturen einbezogen werden können. Es wäre aber nett, wenn Sie mir nochmal
erläutern könnten, wie ein Austausch von Elektronen zwischen den beiden Ringen erfolgen kann.
A: Sie meinen vermutlich diese Webseite.
Es ist richtig, dass eine Elektronenverschiebung zwischen dem phenolischen und dem chinioiden Sauerstoffatom
über das Brücken-Sauerstoffatom nicht stattfinden kann. Diese Verschiebung von Doppelbindungen würde eine
Lichtabsorption erlauben, die dem klassischen Vorgang entspricht: Elektronen gehen aus dem Doppelbindungsorbital
(Symbol p) in das angeregte Doppelbindungsorbital (Symbol p*;
ausgesprochen "Pi-Stern") über. Man spricht von einem (p->p*)-Übergang.
An der Farbgebung des Eosins sind vor allem die nichtbindenden Elektronen des zentralen Sauerstoffatoms
beteiligt. Bei Anregung gehen sie vom nichtbindenden Atomorbital (Symbol n) in das angeregte Doppelbindungsorbital
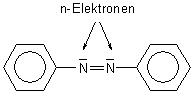
über. Solche (n->p*)-Übergänge kommen auch bei der Stickstoffbrücke im Azobenzol vor.
Bekanntlich ist auch dessen Farbigkeit (Azobenzol ist rotorange gefärbt!) anhand einfacher Mesomerievorstellungen
(wie zeichenbarer Elektronenverschiebungen mit entsprechenden Grenzstrukturen) nicht zu erklären.
1337
F: Auf einer Coca-Cola-Flasche habe ich in der Zusammensetzungsliste den
Zusatzstoff E 150d entdeckt. Was bedeutet das d?
A: Unter der E-Nummer 150 versteht man nicht nur die typischen Zusätze
von Karamelpudding, sondern auch die sogenannte Zuckercouleur, die die Cola-Getränke braun färbt. E 150 enthält
Zusatzbezeichnungen von a bis d. Karamel(-Aroma) und Zuckercouleur werden aus Kohlenhydraten hergestellt, die in
Gegenwart von sauren und/oder basischen Katalysatoren erhitzt werden.
Die Buchstaben geben Aufschluss darüber, welcher Ausgangsstoff und welches Verfahren genutzt wurden. Der Buchstabe
d steht für einen Glucosesiurup, der in der Gegenwart von Schwefelsäure und Ammoniak erhitzt wurde. (Man verwendet
auch Ammoniumsulfat.) Insgesamt kommt es (verglichen mit der Karamelisierung) nicht nur zur intensiveren Dunkelfärbung,
sondern auch zur Bildung hochpolymerer Produkte und weniger zur Aromabildung. Gleichzeitig wird das Produkt sulfoniert.
Das erhöht die Löslichkeit und stabilisiert die Emulsion. Diese sulfonierte Zuckercouleur ist ganz besonders in sauren
Getränken stabil. Allerdings kommt es auch bei derartigen Getränken bei längerem Stehenlassen zum unschönen und
unappetitlichen Ausflocken der Zuckercouleur.
1338
F: Immer wenn ich mit Eiweiß bzw. Eigelb ( roh ) behaftetes Geschirr in
den Geschirrspüler stelle, riecht das gesamte Geschirr (vor allem das Porzellan) nach dem Spülen unangenehm.
Das gleiche geschieht auch, wenn man das Geschirr per Hand abwäscht und auch unabhängig vom Spülmittel. Den
gleichen Geruch kann man wahrnehmen, wenn es im Sommer geregnet hat und viele Regenwürmer auf den Wegen liegen,
wirklich! Ebenso habe ich den Geruch während eines zoologischen Praktikums beim Präparieren feststellen können.
Ich vermute, dass es sich um eine Reaktion mit Eiweiß handelt. Wissen Sie irgendetwas darüber, und vielleicht
auch, wie man dem entgegenwirken könnte?
A: Beim Stinkekram handelt es sich um (vor allem schwefelhaltige)
bakterielle Zersetzungsprodukte von frischem, noch nicht allzu denaturiertem Eiweiß. Ich hasse das auch.
Alles riecht dann: Gläser, Besteck... Dagegen gibt es leider kein echtes Mittel. Es gibt zwar so genannte
Stahlseifen (-> Kurze Frage Nr. 1068). Diese Stahlstücke soll man während des Waschens in die
Geschirrspülmaschine legen. Sie aktivieren auf katalytische Art und Weise die Geruchsmoleküle und machen
sie so zur Oxidation oder Hydrolyse bereit. Sie wirken aber recht langsam.
Wir zu Hause gehen so vor, dass wir mit Ei (und eihaltigen Speisen wie Majo) sowie mit Fleischresten
behaftetes Geschirr mit Geschirrspülmitteln vorspülen. Erst dann geben wir es in die Geschirrspülmaschine.
Wenn es tatsächlich passiert, dass dennoch Geruch entsteht, wiederholen wir den kompletten Spülgang.
Wichtig auch: Nach dem Spülen muss die Maschine zum Lüften sofort geöffnet werden.
1339
F: Man findet überall Angaben über den Aufbau des Hämoglobinmoleküls,
aus wie viel Aminosäuren es besteht und so weiter. Aber es fehlen Angaben zur echten Größe des Moleküls.
A: Hämoglobin (Hb) ist ein kugeliges (globuläres) Protein. Es ist
aus vier Untereinheiten zusammengesetzt: Zwei a-Ketten (141 Aminosäuren) und zwei
b-Ketten (146 Aminosäuren). Der Durchmesser des gesamten Hb-Moleküls beträgt 66-69
Å bzw. 6,6-6,9 nm.
Grundsätzlich liegen die Durchmesser der meisten globulären Proteine in der Größenordnung 5-10 nm.
Bedenken Sie aber, dass dies die Maße des Moleküls im Hb-Kristall sind. In Lösung trägt das Hb-Molekül
noch eine große Hydrathülle.
1340
F: Ich muss gelegentlich Maßlösungen ansetzen und bin auf Ihren Artikel
über Schwefel- und Phosphorsäurelsg aus Salzen gestoßen - prima Tipp für kurzfristige Praktika! Allerdings würde
ich auch gerne wissen, wie man "korrekt" vorgeht.... - konkreter Fall: Rauchende Salzsäure / Konz Schwefelsäure
stehen im Vorratsschrank und benötigt werden 1- oder 0,1-molare Maßlösungen zum Titrieren.
Wie wird verdünnt? Praktisches Vorgehen (was wird vorgelegt usw.)? Irgendwelche un-offensichtlichen Gefahren?
A: Das Problem ist nicht nur, solche Lösungen richtig zu verdünnen.
Während Sie arbeiten, dampft Ihnen eine Menge an Säurebildnern ab. Sorgen Sie erst einmal dafür, dass das
Abdampfen aufhört, indem Sie die Lösungen grob verdünnen. Dann stellen Sie den Titer fest (durch Titration
mit Natronlauge) und verdünnen Sie anschließend auf die gewünschte Konzentration. So hat man es früher gemacht.
Andernfalls gibt es komplizierte Dichtebestimmungen, aus denen mit Hilfe von Tabellenwerken wie dem Küster-Thiel
die Säurekonzentrationen ermittelt werden können. Aber das Letztere ist höchst ungenau.
Besser ist es, wenn Sie genau arbeiten müssen, die Maßlösungen als Ampullen zu kaufen.