Eosin - Warum reagiert die rote Lehrertinte nicht mit Tintenkillern?
Der Farbstoff der roten Lehrertinte heißt Eosin (griech. Eos; Göttin der Morgenröte). Der ist durch Tintenkiller nicht zu löschen.
Chemisch gesehen ist Eosin ein mit vier Bromatomen substituiertes Fluorescein. Gemeinsam mit Fluorescein hat Eosin die Eigenschaft, unter UV-Bestrahlung zu leuchten: Seine Lösungen fluoreszieren.
Von der Struktur her gehört Eosin zu den Triphenylmethanfarbstoffen. Jedoch weist es (wie Fluorescein) eine Besonderheit auf, die seine Eigenschaften entscheidend verändert: Eosin hat einen zusätzlichen Ring im Molekül, einen Pyranring (siehe Bilder unten). Hängt die Unwirksamkeit des Tintenkillers vielleicht damit zusammen?
Der Grund für die Farbigkeit von Triphenylmethanfarbstoffen ist, dass die Moleküle wegen der sp2-Hybridisierung des zentralen C-Atoms völlig planar sind. Damit können sich die p-Elektronen der Doppelbindungen und die nichtbindenden Elektronen der Substituenten über das ganze Molekül verteilen ("delokalisieren"); wir sprechen von "Mesomerie" bzw. vom "mesomeren Zustand". Solche Elektronen sind leicht anregbar und absorbieren deshalb energiearme Strahlung aus dem sichtbaren Spektrum. Der nichtabsorbierte Spektralanteil addiert sich zum sichtbaren Farbeindruck.
Wir hatten bei "normalen" Triphenylmethanfarbstoffen wie Fuchsin oder Kristallviolett gesehen, dass durch die Addition der Anionen des Tintenkillers an das zentrale C-Atom die Geometrie des Farbstoffmoleküls total verändert wird: Es verliert seine für die Farbigkeit notwendige sp2-Planarität und nimmt die Form einer sp3-Pyramide an.
Es gibt für Eosin zwei mögliche Strukturformeln, die vom pH-Wert ihrer Lösungen abhängen. Das ist genauso wie beim Phenolphthalein. In Bild 1 zeigen wir zunächst für beide Stoffe diejenigen Strukturen, die im alkalischen Milieu vorliegen. Weil einer der aromatischen Ringe formal die Bindungsverhältnisse eines Chinons aufweist, nennt man diese Struktur "chinoid". Für die Farbgebung ist in beiden Verbindungen weitgehend nur der obere Bereich der Strukturen verantwortlich. Wir können hier eine Reihe von Grenzstrukturen formulieren. Beim Phenolphthalein betrifft das den Wechsel der negativen Ladung bzw. der chinoiden Struktur von links nach rechts. Beim Eosin kommt für die Elektronen noch ein weiterer Weg über das Sauerstoffatom des Pyranrings in Frage. Die alkalischen Lösungen der beiden Stoffe sind deshalb rot.
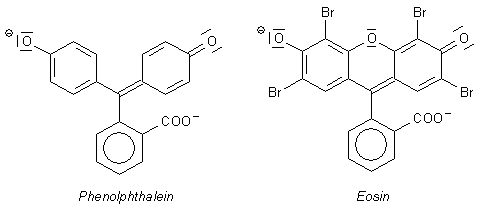
Bild 1: Chinoide Formen von Phenolphthalein und Eosin im alkalischen Milieu
Im sauren Milieu ist das alles ein wenig anders. Im Folgenden besprechen wir die beiden Farbstoffe getrennt.
1 Phenolphthalein
Die "chinoide" Form des Phenolphthaleins ist rot, weil hier das zentrale C-Atom sp2-hybridisiert
ist (siehe Bild 1). Damit liegt ein planares Molekül vor, das durch mesomere Zustände beschrieben werden kann.
In dieser Form kann Phenolphthalein durch Addition von Anionen entfärbt werden. So ist die Beobachtung zu
erklären, dass sich der rote Farbstoff in starker Natronlauge entfärbt; es bildet sich eine so genannte
Carbinolbase.
Im sauren Milieu dagegen ist Phenolphthalein von vornherein farblos. Dazu bedarf es keines "Farbkillers". Der Grund ist die spontane Bildung eines Lactons, eines innermolekularen, ringförmigen Esters (siehe Bild 2). Die Lactonform ist farblos, weil das zentrale C-Atom sp3-hybridisiert ist und ein großflächiger mesomerer Zustand als Ursache für die Farbigkeit nicht mehr möglich ist. Die beiden aromatischen Ringe verhalten sich wie unabhängige farblose Phenolmoleküle.
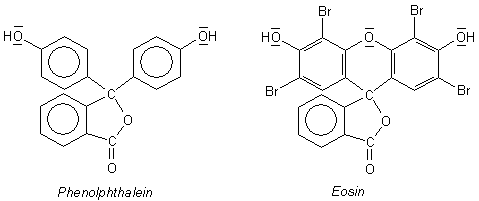
Bild 2: Die Lactonformen von Phenolphthalein und von Eosin im sauren Milieu
2 Eosin
Beim Eosin ist das anders. Bei diesem erkennen wir trotz der Änderung des pH-Werts der Lösungen keine
sonderliche Farbänderung (abgesehen vom veränderten Fluoreszenzverhalten).
Grund: Die Farbigkeit von Eosin resultiert nicht nur im alkalischen Milieu aus den oberen drei Ringen
("Dibenzopyran") (Bild 1), sondern auch im sauren Milieu, und das, obwohl auch hier formal zwei Phenolmoleküle
vorliegen (Bild 2). Der Grund für die unveränderte Farbigkeit ist, dass (wie schon erwähnt) auch das Sauerstoffatom im
Pyranring als wichtiger Faktor an der Farbigkeit beteiligt ist.
Zur Erklärung müssen wir etwas ausholen:
Eine Elektronenverschiebung zwischen dem phenolischen und dem chinoiden Sauerstoffatom über das
Brücken-Sauerstoffatom kann nicht stattfinden. Diese Verschiebung von Doppelbindungen würde eine
Lichtabsorption erlauben, die dem klassischen Vorgang entspricht: Elektronen gehen aus dem
Doppelbindungsorbital (Symbol p) in das angeregte Doppelbindungsorbital (Symbol p*; ausgesprochen
"Pi-Stern") über. Man spricht von einem (p->p*)-Übergang.
Ein solcher Übergang sollte pH-abhängig sein, das heißt, vom Dissoziationszustand der beiden phenolischen
Gruppen beeinflusst werden können.
An der Farbgebung des Eosins sind dagegen vor allem die nichtbindenden Elektronen des zentralen
Sauerstoffatoms beteiligt. Bei Anregung gehen sie vom nichtbindenden Atomorbital (Symbol n) in das
angeregte Doppelbindungsorbital über. Solche (n->p*)-Übergänge kommen auch
bei der Stickstoffbrücke im Azobenzol vor. Bekanntlich ist auch dessen Farbigkeit anhand einfacher
Mesomerievorstellungen (wie zeichenbarer Elektronenverschiebungen mit entsprechenden Grenzstrukturen)
nicht zu erklären.
Eine Entfärbung erfolgt deshalb auch dann nicht, wenn das zentrale C-Atom durch die Lactonringbildung im sauren Milieu sp3-hybridisiert wird. Dann läuft der Elektronenaustausch zwischen den Phenolen oben über die Sauerstoffbrücke.
Statt des Lactonringschlusses kann beim Eosin natürlich auch ein HSO3--Ion am zentralen C-Atom angreifen - aber ohne jegliche farblöschende (tintenkillende) Wirkung.
Resümee
Wir können es modellhaft auch so sagen: Tintenkiller verschließen bei den normalen Triphenylmethanfarbstoffen
den klassischen Elektronenweg über das zentrale C-Atom.
Eosin hat mit dem Sauerstoffbrückenatom ein alternatives Farbgebungssystem. Deshalb wirken Tintenkiller nicht.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 15. Januar 2012, Dagmar Wiechoczek