 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1411
F: Glucose und andere reduzierende Zucker reagieren mit Tollens-Reagenz
(ammon. Silbernitratlösung) oder Fehling. Nicht reduzierende Zucker wie einige Disaccharide (Saccharose) nicht.
Diese haben doch aber OH-Gruppen. Diese sollten auch reagieren, wie auch Glycerin mit Tollens reagiert, oder nicht?
Sind es nicht auch in der Glucose auch OH-Gruppen, die reagieren? Wenn es nur die Aldehydgruppe ist, wie in den
Schulbüchern behauptet, dann verstehe ich nicht warum.
A: Es sind nicht alle OH-Gruppen, die reduzieren. Sie müssen die rein
alkoholischen unterscheiden von denen, die aufgrund der Ringbildung versteckte Aldehyde bzw. Ketone sind. Stichwort:
Acetale bzw. Ketale. Solche OH-Gruppen sind diejenigen am C-Atom 1 bei der Glucose und am C-Atom 2 bei der Fructose.
Im alkalischen Milieu der Proben werden die Ringe geöffnet, und es entstehen wieder die freien Carbonylgruppen.
Gleiches gilt auch für die dimeren Zucker Maltose, Lactose usw. Diese sind von C1 -> C4 gebunden. Deshalb kann jeweils einer der beiden Ringe geöffnet werden und reduzierend wirken.
Bei der Saccharose ist es aber so, dass die beiden reduzierenden OH-Gruppen an C1 der Glucose und C2 der Fructose gegeneinander verknüpft sind. Deshalb können sich die Ringe nicht öffnen, und die Reduktionswirkung bleibt aus.
Beim Glycerin haben wir eine Ausnahme. Das reagiert sogar schon mit Fehling in der Kälte, wenn ich mich richtig erinnere. Warum das so oxidationsempfindlich ist, weiß ich nicht.
1412
F: Ich möchte ein Chemiestudium beginnen, nun haben mir aber einige Wenige
(Bekannte) davon abgeraten, weil man mit einer Rot-Grün-Schwäche keine zuverlässigen Laborarbeiten durchführen könne
und dies auch für das weitere Berufsleben ein ewiges Handicap sei…. Stimmt das?
A: Farbigkeit gehört zwar mittlerweile zu den objektivierbaren Stoffeigenschaften;
aber dem persönlichen Eindruck ist in der Laborarbeit oftmals der Vorzug zu geben.
Wenn Sie nur unter einer Rot-Grün-Schwäche leiden, steht dem Studium wohl nichts im Wege. Aber eine Rot-Grün-Blindheit ist sicherlich erschwerend, vor allem in der Ausbildung.
Nun geht es ja nicht nur um Ihr Studium, sondern auch um Chancen hinsichtlich Ihrer späteren Berufstätigkeit. Ich würde direkt den Verband der chemischen Industrie (www.VCI.de) anschreiben und mich beraten lassen.
1413
F: Ich bin auf folgendes - für mich unbegreifliches Problem gestoßen.
Ich wollte die unterschiedlichen Süßstoffe und Zucker in Bonbons untersuchen. Mir gelingt allerdings bei Aspartam
versetzte Lösungen keiner der Peptidnachweise (uU ist die Kupfersulfatlösung etwas orange/lila - was natürlich
auch ein leicht pos Fehling sein kann) Es gelingt keine Xanthoproteinr. obwohl Phenylalanin aromat. Ist und auch
kein Ninhydrin! Biuret ist äußerst unspezifisch.
A: Aspartam hat folgende Struktur:
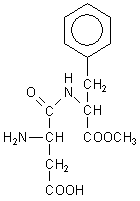
Danach dürfen Sie nicht erwarten, dass hier alle bekannten Peptid- und Proteinnachweisreaktionen greifen. Die
Peptidbindung ist z. B. durch voluminöse Reste innerhalb des Moleküls sehr versteckt. Hinzu kommt, dass die von
Ihnen vorgenommenen Nachweise sehr grob sind und hohe Konzentrationen des nachzuweisenden Stoffs benötigen.
Sie müssten den Süßstoff deshalb zuvor anreichern. Das ist aber ohne weitere Erfahrung recht schwer – wenn man
an all die anderen, vielleicht störenden Substanzen denkt, die in Ihren Bonbons enthalten sind oder sein können.
Andere Möglichkeiten beruhen auf apparativen Methoden wie der HPLC oder Ionenchromatographie. Fazit: Es gibt nun mal Sachen, die in der Schule nicht machbar sind. Das betrifft nach meiner Erfahrung vor allem viele Vorschläge zur „Chemie im Kontext“.
Vielleicht fragen Sie ein (lebensmittel)chemisches Untersuchungsamt.
1414
F: Ich habe eine Frage und zwar, wie kann man die Atome von etwas (z.B.
Kochsalz) trennen? Ich bin Schülerin der 7. Klasse und bitte Sie mir sobald Sie Zeit haben zu antworten.
A: Eine schwierige Frage für eine Siebtklässlerin!
Kochsalz besteht aus Kristallen. Die wiederum bestehen aus Natriumteilchen und Chlorteilchen. Es handelt sich
bei den Teilchen um abgewandelte Atome, um „Ionen“. Die sind elektrisch entgegengesetzt geladen und ziehen sich
daher gegenseitig an. Das hält den Kristall zusammen. (Ähnliches kennst du von den Polen zweier Magneten.)
Die Ionen kannst du einmal trennen, indem du die Kochsalzkristalle in Wasser gibst. Dann schieben sich die
Wasserteilchen („Moleküle“) zwischen die Ionen und drücken sie auseinander. Anschließend umhüllen die Wasserteilchen
die Ionen und tragen sie von der Kristalloberfläche weg.
Wenn du das Wasser verdunsten lässt, kannst du die Kristalle wieder bekommen. Dann treffen sich die entgegengesetzt
geladenen Ionen wieder und bauen den Kristall wieder auf.
Wenn du die Atome des Salzes bleibend auseinander nehmen willst, musst du so vorgehen: Das Salz musst du zunächst schmelzen. Bei der hohen Temperatur werden die Ionen voneinander getrennt; sie schwirren in der Schmelze herum. Dann schickst du elektrischen Gleichstrom hindurch. Dabei wandern die positiven Natrium-Ionen zum negativen Pol der Batterie, die negativen Chlorid-Ionen wandern zum positiven Pol. An den Polen werden die Ionen entladen; es entstehen ungeladene Atome von Natrium und von Chlor, die du voneinander getrennt aufbewahren musst. Denn die wollen sich augenblicklich wieder vereinigen und in einer heftigen Reaktion das Kochsalz zurückbilden!
1415
F: Ich würde gerne wissen, ob man Atome, die stabil sind, so weit vergrößern kann,
dass diese Atome instabil werden. Ich bin Schülerin der 7. Klasse und hoffe, dass Sie mir helfen können.
A: Das geht tatsächlich. Man kann Atome mit anderen Atomen beschießen.
Dann vereinigen sich die Atomkerne und werden so instabil, dass sie bald wieder zerfallen. So kann man zum Beispiel
die Kerne von Tantalatomen mit denen von Kohlenstoffatomen vereinigen; es bildet sich dann Gold, dessen Atomkerne
leider aber instabil sind. Auf diese Weise hat man für eigentlich alle Elemente instabile Formen hergestellt. Auch
ganz neue, „künstliche“ Elemente werden so hergestellt. Sie sind aber – wie du schon richtig gesagt hast – instabil,
„radioaktiv“. Das heißt, sie zerfallen unter Abgabe von Strahlung (lat. radius, Strahl).