 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
461
F: Unlängst hatte mir ein Mediziner erklärt, dass eingenommene
Zitronensäure im Körper basisch wirkt und damit Harnsäurewerte senken könnte. Unabhängig von der
medizinischen Aussage, wie kann eine Säure biochemisch im Körper als Base wirken. Gibt es da
eine Antwort und stimmt's?
A: Bei vielen Medizinern gehen chemische Begriffe wie Säuren
und Basen sowieso immer etwas durcheinander. Aber die Aussage Ihres Mediziners ist wohl anders gemeint:
Dass mit Gabe von Citronensäure (CS) deren Abbauweg, der bekannte CS-Zyklus, aktiviert wird. In den
münden nämlich auch die Abbauwege der Aminosäuren (vor allem über Asparaginsäure und Glutaminsäure).
Diese spielen eine wichtige Rolle bei der Bildung von Ammoniak, das beim Abbau der Aminosäuren
abgespalten wird. Dieses ist eine Base und wird rasch in Ammonium-Ionen umgewandelt, die dann
über die Niere ausgeschieden werden. Sie können aber auch in den Harnstoffzyklus münden,
werden dort mit CO2 zu Harnstoff gekoppelt und dann als typisches Säugetierendprodukt
ausgeschieden.
Andererseits ist die Synthese der Vorläufer der Harnsäure ebenfalls an das Vorhandensein der
gleichen Aminosäuren Glutaminsäure und Asparaginsäure gebunden. Werden letztere anders verstoffwechselt,
könnte man meinen, dass die Harnsäure abnimmt. Die Harnsäure wird aber nicht zum Zwecke des Ausscheidens
von Ammoniak synthetisiert, sondern zum Aufbau von Bausteinen zum Beispiel des ATP (-> Energiestoffwechsel)
und von Basen für DNA und RNA.
Inwieweit das tatsächlich so schlicht abläuft und Auswirkungen zum Beispiel auf Gicht hat, will
ich nicht beurteilen. Das dürfte aber auch einer starken individuellen Schwankung unterliegen.
462
F: Folgende Fragen kann ich nicht beantworten:
1. Erklären sie auf der Grundlage des Massenwirkungsgesetztes folgende Feststellung: Die
Umsetzung von Schwefeldioxid zu Schwefeltrioxid wird durch die Zwischenabsorbtion vollständiger.
2. (geht glaube von der antwort her in die selbe richtung) Warum wird beim Doppel-Kontakt-verfahren
der Umsatz auf 99.8% gesteigert?
3. Welche Anforderungen ( Druck, Temperatur etc. ) werden an eine großtechnische Produktion gestellt?
A: Die Bildung von SO3 ist eine Gleichgewichtsreaktion.
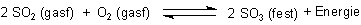
Ihre Fragen betreffen das Prinzip von -> Lechatelier: Ein Gleichgewichtssystem reagiert auf äußeren Zwang so, dass es die Auswirkungen des Zwangs minimiert.
| 1 |
Wenn Sie mit "Zwischenabsorption" das zwischenzeitliche Durchleiten der Reaktionsmischung durch verdünnte Schwefelsäure meinen, wobei diese das SO3 bindet: Das Produkt wird aus der Reaktionsmischung entfernt. Damit verschiebt sich das Gleichgewicht in Richtung auf Produktbildung. |
| 2 |
Genau genommen handelt es sich beim Doppelkontaktverfahren nur um die Erweiterung von drei auf vier Katalysatorschichten, durch die das SO2/O2-Gemisch geleitet wird. Diese Schichtung ermöglicht, zwischendurch immer wieder die Temperatur zu senken, indem die hohe Reaktionswärme über Wärmeaustauscher abgeleitet wird. Damit verschiebt sich das Gleichgewicht in Richtung SO3-Bildung. Hinzu kommt, dass mit Hilfe mehrerer Kontaktschichten ("Horden") die Verweildauer des Reaktionsgemischs am Kontakt deutlich erhöht wird. Denn Gleichgewichte benötigen bekanntlich eine gewisse Zeitdauer zur Einstellung! Die Horden und ihre Ausbeute: 1 -> 60 %, 2 -> 90 %, 3 -> 95 %, 4 -> 98 %. |
| 3 |
Hoher Druck steigert die SO3-Bildung, da gemäß der Reaktionsgleichung drei Mol Gase zugunsten
der Festkörperbildung verschwinden. Bei der hohen Reaktionstemperatur werden aus 3 Molen allerdings
zwei Mol Gas, weil SO3 hier dampfförmig vorliegt, was aber auf das gleiche hinausläuft:
Volumenverringerung als Antwort auf Druckausübung.
|
463
F: Am freitag schreiben wir eine chemie klausur und wir haben auch
über das galvanische element gesprochen. allerdings habe ich ein problem: ich habe die funktion des
tonzylinders nicht ganz verstanden.
unser lehrer erklärte uns, dass durch den eben genannten zylinder sulfationen aus der kupfersulfatlösund
in die zinksulfatlösung bzw. zinkionen aus der zinksulfatlösung in die kupersulfatlösund diffundieren.
da die elektronen von der anode zur kathode fließen (zumindest beim galvanischen element) wird die
Lösung rund um die Anode positiver, die lösung um die kathode hingegen negativer.
was bewirkt aber der tonzylinder bei der ganzen sache und wie macht er das??
Ich wäre ihnen wirklich sehr verbunden wenn sie mir möglichst schnell antworten würden.
A: Das Daniellelement ist
Zn/ZnSO4-Lösung // CuSO4-Lösung/Cu
Die Reaktionsgleichungen des Daniell-Elements sind
Oxidation (Anodenraum): Zn ———> Zn2+ + 2 e-
Reduktion (Kathodenraum): Cu2+ + 2 e- ———> Cu
Der Tonzylinder ist porös. Man spricht vom Diaphragma. Es ermöglicht den Durchfluß von Sulfat-Ionen,
die beim Betrieb des galvanischen Elements vom elektrischen Feld zur Anode "gezogen" werden. Das ist
notwendig, damit der Stromkreis geschlossen wird: Je zwei Elektronen im äußeren Stromkreis ziehen in
der Lösung sozusagen ein Sulfat-Ion aus dem Kathodenraum mit der Cu-Elektrode in den Anodenraum mit
der Zn-Elektrode nach. Wenn das nicht wäre, bliebe das Element nach kurzer Zeit "stehen".
Die Sulfatwanderung darf aber auf keinen Fall durch eine entgegengesetzte Zink-Ionenwanderung
ausgeglichen werden! Dein Lehrer liegt da also nicht richtig. Die Sulfat-Ionen wandern aus, weil
im Anodenraum die positiven Zn-Ionen in dem Maße zunehmen, wie die positiven Cu-Ionen im Kathodenraum
abnehmen.
Zur Sulfatwanderung brauchte man eigentlich kein Diaphragma. Der Tonzylinder schränkt jedoch
zusätzlich das vom elektrischen Feld unabhängige, ungerichtete Diffundieren der Cu-Ionen in den
Anodenraum ein, was vor allem bei einem nichtbelasteten galvanischen Element geschehen würde. Die
herumvagabundierenden Cu-Ionen würden sich nämlich ohne Diaphragma-Sperre sofort auf die Zinkelektrode
stürzen und sich als Metall niederschlagen und damit das Daniell-Element zerstören.
Cu2+ + Zn ———> Cu + Zn2+
Umgekehrt stören Zink-Ionen nicht, denn die reagieren nicht mit dem Kupfer.
Natürlich werden die Zink-Ionen bei Belastung des Elements auch nicht in den Kathodenraum wandern
können - bei dem gewaltigen Gegenstrom von negativ geladenen Sulfat-Ionen mit großer Hülle aus
Wassermolekülen ein mehr als schwieriges Unterfangen!
464
F: Ich habe eine Frage zum Thema Chemie, welch wie folgt lautet:
"ist es richtig, dass ein Stoffgemisch physikalisch trennbar ist, eine Stoffverbindung aber nicht?"
Ich würde mich sehr über ihre antwort freuen.
A: Bei physikalischen Prozessen ändern sich die Stoffeigenschaften
nicht, bei chemischen Abläufen ändern sie sich.
Eine physikalische Trennung von Stoffgemischen, also die Auftrennung einer Ansammlung von nebeneinander
vorliegenden Reinstoffen, darf die Stoffeigenschaften nicht verändern: Beispiele sind Destillieren,
Chromatographieren, Filtrieren und so weiter.
Eine chemische Verbindung beruht auf chemischen Bindungen zwischen den Atomen der beteiligten Elemente.
Die chemischen Bindungen kannst du nur mit chemischen Mitteln lösen. Dabei ändert sich allerdings auch die
Eigenschaft der Stoffe. Beispiele sind Elektrolyse und Reduzieren von Eisenoxid mit Kohle (usw.).
465
F: Ich möchte eine Teppichboden Velour oder Schling in schwarz
färben. Der Teppich ist ca.70 cm breit und 1 m lang. Welche Farbstoffe usw brauche Ich ? und wo
kann Ich diese erhalten.? Es ist nicht nur ein Teppich Ich hätte noch mehr zu färben. Ich dachte
mir zb. das Färben in einer Wanne vorzunehmen (Farbbad).Ist sowas möglich?
A: Leider kann ich Ihnen da keinen Tipp geben. Zum Beispiel
weiß ich nicht, aus welchem Material Ihr Stoff besteht. Wenn er aus Kunststoff besteht, dann ist
nachträgliches Färben kaum möglich, da man die Farbstoffe (ohne große chemische Klimmzüge zu machen)
nicht aufziehen kann.
Hinzu kommt, dass es Ihnen kaum gelingen wird, die Reste der Färbelösung (Flotte) ausreichend
auszuspülen. So werden Sie ständig von Emissionen bedroht sein. Außerdem können Sie beim Entsorgen
der Färbebäder und der Spülwässer in arge Schwierigkeiten mit der Umweltgesetzgebung geraten. Lassen
Sie die Finger davon.