
| Bei chemischen Reaktionen verändert sich |
| die Masse der beteiligten Stoffe nicht |
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
|
1 Wenn eine Kerze verbrennt, wird sie leichter, denkst du. Man kann ja förmlich zusehen, sagst du. |
Stelle eine Kerze auf eine Waage, entzünde sie und beobachte. Stimmt, die Kerze wird leichter. Nun erinnere dich aber daran, dass beim Verbrennen Abgase entstehen. Halte zum Beispiel ein kaltes Becherglas über die Flamme. Du erkennst Wasserdampf und schwarzen Ruß.

Bild 1 (Foto: Daggi)
|
2 Manches kann beim Verbrennen aber auch offenbar schwerer werden! |
In die Schalen der Waage stellen wir zusätzlich zwei Porzellan- oder andere feuerfeste Schalen. In eine
Schale legen wir einen Ballen Stahlwolle aus dem Baumarkt. Die Stahlwolle müssen wir zuvor mit Alkohol gut
entfetten. Die Stahlwolle danach wirklich gut trocknen lassen! Tariere die Waage aus, indem du in die
Gegenschale vorsichtig Sand häufelst. Dann nehmen wir die Schale mit der Stahlwolle herunter und glühen
sie mit einem Gasbrenner richtig durch. Dazu müssen wir die Stahlwolle ab und zu drehen.
Achtung, die Schale ist heiß! Deshalb stellen wir sie mit Hilfe einer Zange auf die Waagschale.
Die Schale mit der Stahlwolle sinkt nun deutlich ab. Offenbar wird Eisen (anders als die Kerze) beim
Verbrennen schwerer.

Bild 2 (Foto: Daggi)
|
Es ist also etwas hinzugekommen. Das ist der Sauerstoff aus der Luft! Der hat sich mit dem silbrigen Eisen zu schwarzem, bröseligem Eisenoxid verbunden. Dieses Eisenoxid haben wir schon kennengelernt! |
|
Was denn nun? Verändern sich bei chemischen Reaktionen die Massen - ja oder nein? Na klar: Beim Abbrennen der Kerze gab es gas- und dampfförmige Stoffe ("Produkte"). Die entzogen sich unserer Wägung! Die Kerze wurde scheinbar leichter. Bei der Stahlwolle dagegen entsteht ein fester Stoff. Der konnte nicht entschwinden, und den haben wir dann richtig wiegen können. Planen wir den Versuch also neu. 3 Jetzt untersuchen wir eine andere chemische Reaktion. |
Wir geben 5 Streichholzköpfe (oder auch mehr, aber nicht zuviel!) in ein Reagenzglas. Auf keinen Fall ganze Streichhölzer nehmen; die können beim Erhitzen nämlich wie kleine Raketen aus dem Glas schießen und den Ballon beschädigen. Das Glas verschließen wir gut mit einem Luftballon, den wir gut über den Rand des Gläschens ziehen. Wichtig: Den Ballon musst du durch einmaliges kräftiges Aufpusten kurz vordehnen!
Das Reagenzglas legen wir samt Ballon auf die eine Waagschale und tarieren die Waage wieder mit Sand
aus. Nun setzen wir die Schutzbrille auf und erhitzen mit einem Gasbrenner das Glas an seinem unteren Ende,
bis sich die Streichholzköpfchen entzünden. Keine Angst dabei!
Lasse abkühlen. Betrachte die Waage: Das Gewicht hat sich nicht verändert!
Klar, das kann es ja auch nicht: Es konnten ja keine Abgase entweichen oder Luft von außen hinzukommen,
da das Reagenzglas verschlossen war.
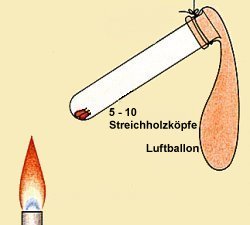
Bild 3 (Quelle: Cornelsen)
Wir lernen daraus ein wichtiges Gesetz der Chemie: Bei chemischen Reaktionen
verschwindet keine Masse!