Versuch: Eigenschaften von Kohlenstoffdioxid
Schülerversuch; 15 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Geräte
3 Bechergläser (100 ml), Winkelröhrchen, Gummischlauch, Waage.
Chemikalien
Mineralwasser(-flasche), Kalkwasser (C), Teelicht.
Durchführung
Eine neue Mineralwasserflasche wird geöffnet und
ca. ein Drittel des Wassers abgegossen. Anschließend wird
die Flaschenöffnung mit einem einfach durchbohrten Stopfen
verschlossen, in dem ein Winkelröhrchen mit einem ca. 40 cm
langen Schlauch steckt.
a) Die Flasche wird leicht geschüttelt, so dass das
gelöste Gas entweicht. Das Schlauchende hält man
in ein Becherglas mit einem brennenden Teelicht. Dabei sollte das
Schlauchende bis zum Boden des Glases reichen, damit evtl.
austretendes Wasser nicht in die Kerze tropfen kann.
Nach einiger Zeit hört die Kerze auf zu brennen.
b) Diesmal wird das Schlauchende in ein Becherglas gehalten, welches auf
einer empfindlichen Waage steht. Dabei darf der Schlauch das Becherglas nicht berühren.
Nach einiger Zeit liest man eine Gewichtszunahme an der Waage ab.
c) Das Schlauchende wird in ein Becherglas mit Kalkwasser gehalten, so dass das ausströmende Gas durch die Flüssigkeit perlt. Es entsteht ein weißer Niederschlag in der Lösung. Wird nach dem Auftreten des Niederschlags noch einige Zeit weiter Gas durch die Lösung geleitet, löst sich der Niederschlag wieder auf. Dieser Teilversuch sollte auch mit Luft und ausgeatmeter Luft wiederholt werden.
Auswertung
In Mineralwasser ist Kohlenstoffdioxidgas gelöst, welches
für den perlenden Geschmack des Getränkes verantwortlich ist.
Kohlenstoffdioxidgas ist schwerer als Luft bzw. schwerer als dessen Hauptbestandteil
Stickstoff (Dichte: CO2 : 1,977 g/l, Luft : 1,293 g/l,
N2 : 1,25 g/l), weshalb es die Kerze im Becherglas löscht
und auch eine Gewichtszunahme beim Einfüllen in leere Gefäße
bewirkt.
Kalkwasser ist eine Nachweisreagenz für Kohlenstoffdioxidgas.
Es reagiert damit zu feinverteiltem, in Wasser schlecht löslichem
Calciumcarbonat:
CO2 + Ca(OH)2 à H2O + CaCO3 â
Auch das Kohlenstoffdioxidgas aus der Luft reagiert mit Kalkwasser, allerdings aufgrund seiner geringen Konzentration bedeutend langsamer. Ausgeatmete Luft, deren Kohlenstoffdioxidkonzentration etwas höher ist, trübt die Lösung schneller als Luft.
Wenn weiteres Kohlenstoffdioxid in eine solche Lösung eingeleitet wird, löst sich das Gas in Wasser unter Bildung von Kohlensäure. Dieser Prozess findet auch beim Versetzen von Quellwasser mit Kohlensäure (Mineralwasserherstellung) statt. Dabei stehen Wasser, Kohlenstoffdioxid und Kohlensäure in einem Gleichgewicht miteinander:
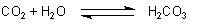
Die entstandene Säure reagiert mit weiteren Wassermolekülen zu Carbonat-Ionen und Oxonium-Ionen, die schließlich mit dem Calciumcarbonat-Niederschlag zu löslichem Calciumhydrogencarbonat und Wasser weiterreagieren:
H2CO3 + 2 H2O à CO3 2- + 2 H3O+
CaCO3 + 2 H3O+ + CO32- à Ca(HCO3)2 + 2 H2O
Dem Phänomen der Wasserhärte von Grundwasser durch Calciumhydrogencarbonat liegt die Reaktion von Kohlenstoffdioxid und Wasser zu Kohlensäure und deren Reaktion mit Calciumcarbonat aus dem Boden zugrunde.
Literatur
R. Blume, Chemie für Gymnasien, D 1, Cornelsen Verlag, Berlin 1994, S. 108.