| Warum ist Indigo eigentlich so intensiv blau? | 
|

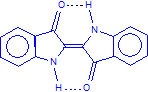
Indigopulver
(Foto: Daggi)
Immer wieder stellen aufmerksame Schüler fest, dass die Moleküle des Indigos für eine derartige Farbtiefe erstaunlich klein sind.
So haben sie bei den Polyenen aus der Reihe der Carotinoide gelernt, dass die Tiefe einer Farbe von der Zahl der Doppelbindungen abhängt,
also von der Länge eines Chromophors. Um das zu verstehen, muss man sich das Molekül des Indigos genauer ansehen.
Indigo ist eine ungesättigte, heterozyklische Verbindung mit bemerkenswert flacher Molekülstruktur.
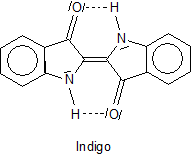
Dass die Farbe des Indigos Blau ist, ist Zufall. Das kommt daher, dass der Farbstoff Licht im Bereich um 610 nm (also im orange-roten
Spektralbereich) absorbiert. Für uns ist wichtig, dass es uns zeigt, dass Indigo zur spektralen Anregung relativ wenig Energie benötigt.
Bemerkenswert ist, dass Substituenten an den Benzolringen offensichtlich nur wenig Einfluss auf die Absorption haben:
| - | Dibrom-Indigo ist zum Beispiel purpurfarben - bekanntlich ist es das Purpur der Antike. Dieser Farbstoff hat sein Absorptionsmaximum bei 601 nm. |
| - | Sulfoniertes Indigo, Indigocarmin, absorbiert bei 618 nm. |
Das alles weist darauf hin, dass die Benzolringe nur wenig an der farbgebenden Mesomerie des Chromophors beteiligt sind. Deshalb können wir sie bei den im Folgenden diskutierten Mechanismen vernachlässigen.
Somit reicht es aus, zum Verständnis der Mesomerie und der damit verbundenen spektralen Anregungen die folgende Struktur zu analysieren.
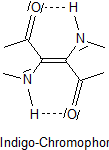
Zur erstaunlichen Farbtiefe bei Vorliegen eines so kleinen Chromophors gibt es eine Theorie: Das Molekül zeigt mesomere Grenzzustände,
bei denen sich die "Elektronenwege" überschneiden. Man spricht hier von doppelt gekreuzter Mesomerie und hält sie für
die Farbtiefe verantwortlich.
Vom farbtheoretischen Standpunkt aus betrachtet handelt es sich um ein asymmetrisches Gebilde aus drei Doppelbindungen, also formal um ein Trien oder um einen Trimethylmethinfarbstoff. Das Stickstoffatom ist Donator für Elektronen, das O-Atom Akzeptor. Da das Trien doppelt vorkommt und sich an den zwei zentralen C-Atomen überschneidet, ist es ein doppelt gekreuztes Chromophor.
Zunächst einmal werden die π-Elektronen des doppelten Triensystems durch Photonen des Lichts angeregt, wodurch sich natürlich auch die Elektronenstruktur des Chromophors verändert.
Bei der Mesomerie und bei der spektralen Absorption spielen auch die nichtbindenden Elektronen der Heteroatome eine zentrale Rolle. Das führt zu Ladungstrennungen und zu polarisierten mesomeren Grenzstrukturen, die durch elektromagnetische Strahlung besonders leicht angeregt werden können.
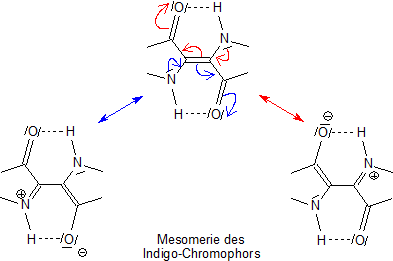
Da auch die nichtbindenden Elektronen (Symbol n) angeregt werden, gehen diese in Zustände über (Symbol *), die eigentlich nur für π-Elektronen
vorgesehen sind. Man spricht von n -> π*-Übergängen. Auch dies führt zu verstärkter Absorption von Strahlung.
Durch die Stabilisierung des Chromophors durch die beiden H-Brücken geht außerdem nur relativ wenig Energie durch Schwingung oder durch intramolekulare Rotation verloren.
Das alles ist Ursache für die hohe Farbintensität des Indigos.
Weitere Texte zum Thema „Indigo“