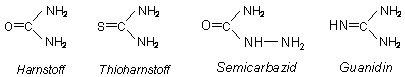
Spezifitäten der Urease
Experimente:
Versuch: Reaktionsspezifität der Urease
Viele wichtige Lernziele der Enzymatik kann man anhand eines einzigen Enzyms
studieren, der Urease (lat. urea, Harnstoff).
Die Urease spaltet (hydrolysiert) Harnstoff, wobei Ammoniak und CO2 entstehen.
O=C(NH2)2 + H2O ——>...——> CO2 + 2 NH3 /exotherm
(Letztlich entstehen Ammonium-, Hydroxid- und Hydrogencarbonat-Ionen.) Die Urease beschleunigt die Reaktion gegenüber der nichtkatalysierten um den Faktor 1014! Sie zeigt bezüglich der Hydrolyse eine ausgeprägte Reaktionsspezifität.
Bekannt ist die Urease auch für eine ausgeprägte Substratspezifität. So werden ähnliche gebaute Verbindungen wie Thioharnstoff, Semicarbazid oder Guanidin nicht umgesetzt.
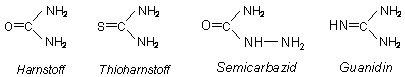
Diese Substanzen wirken gegenüber Harnstoff aufgrund ihrer sterischen Ähnlichkeit als kompetitiver Hemmer, konkurrieren also mit Harnstoff um die Anlagerungs- und sonstigen aktiven Zentren.
Außerdem reagiert die Urease in zu hoher Harnstoffkonzentration nicht mehr: Beispiel für Substrathemmung.
Hinzu kommt noch die spezifische Vergiftbarkeit durch Metall-Ionen. Wirksam sind jedoch nur Komplexbildner. Blei ist nicht wirksam. Bemerkenswert ist, dass das Enzym (Molmasse 480 000 g/mol) 2 Nickel-Ionen als essentielle Bestandteile des aktiven Zentrums besitzt.
Die mögliche Enzymhemmung mit Formaldehyd lässt sich bei der Urease natürlich nicht untersuchen. Denn das Produkt der Urease-Reaktion ist Ammoniak, das bekanntlich mit Formaldehyd Additionsprodukte wie Aldehydammoniak und Urotropin bildet. Deshalb beobachtet man auch keine Rötung der Reaktionslösung.
Die genaue Beschreibung des Enzyms und seiner Reaktionen findet man auf der Webseite Urease für Experten.
Weitere Texte zum Thema „Katalyse“