Die Urease für Experten
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Die Urease ist mit einem weiteren chemiegeschichtlichen Höhepunkt verknüpft: Sie ist das erste Enzym,
das in kristallisierter Form (Oktaeder, die ähnlich wie die des Alauns oder
des Flussspats aussehen) erhalten wurde (1926). Dafür erhielt der Amerikaner
J. B. Sumner 1946 den Nobelpreis.
Reaktion der Urease
Die Urease hat die biochemische Bezeichnung Harnstoff-Amidohydrolase.
Im Enzymkatalog findet man sie unter EC 3.5.1.5. Sie kommt in vielen Pflanzen vor (hier besonders in
der Sojabohne oder Schwertbohne). Aber auch in Schimmelpilzen und in vielen Bodenbakterien ist sie
enthalten. Der Ammoniakgeruch von Gülle hat seinen Grund im bakteriellen Harnstoffabbau.
|
Versuch 1: Zersetzung von Jauche
|
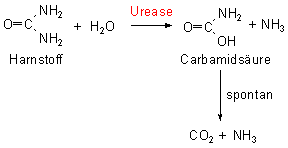
Genau genommen hydrolysiert die Urease den Harnstoff nur zum Teil: Es bildet sich primär die Carbamidsäure (auch "Carbaminsäure" genannt), die spontan zerfällt.

Mit einer Molmasse von 545.000 g/mol ist das Ureasemolekül außergewöhnlich groß. Es besteht aus sechs identischen Untereinheiten mit jeweils 840 Aminosäuren und einer Molmasse von 90.800 g/mol.
Vergiftung der Urease
Trotz ihrer Größe ist die Urease erstaunlich unempfindlich, wie man aus der
Schulpraxis weiß.
Die stark ausgeprägte Substratspezifität des Enzyms gilt auch für die Hemmung durch Schwermetalle. Während Blei-Ionen kaum hemmen, reichen bereits vier Silber-Ionen aus, um ein Ureasemolekül zu blockieren. Auch mit Kupfer-Ionen beobachtet man eine starke Hemmwirkung.
|
Versuch 2: Hemmung der Urease durch Schwermetall-Ionen
Schülerversuch; 10 min. Geräte:
Chemikalien:
Durchführung:
Ergebnis:
|
Die Hemmung durch Schwermetall-Ionen ist übrigens reversibel. Als entgiftende Substanzen setzen wir EDTA oder die Aminosäure Cystein ein. Dies sind starke Komplexbildner, die mit der Urease um die Schwermetall-Ionen konkurrieren.
|
Versuch 3: Reversible Hemmung der Urease durch Schwermetall-Ionen Schülerversuch; 10 min. Geräte:
Chemikalien:
Durchführung:
In vier weitere Reagenzgläser gibst du je 1 ml Wasser und eine Spatelspitze Urease und suspendierst das Enzym durch Schütteln. Zu dreien dieser Ureasesuspensionen pipettierst du 0,1 ml einer Kupfersulfatlösung und lässt 2 - 3 min einwirken. Ein Reagenzglas bleibt ohne Schwermetallzusatz; es dient zum Vergleich. Dann gießt du die Harnstofflösungen zu den Ureasesuspensionen. Den Vergleichsansatz vereinigst du mit RG 1. Ergebnisse:
|

(Foto: Daggi)
Vergiftung der Urease durch Formaldehyd?
In manchen Büchern wird die Vergiftung der Urease durch Formaldehyd beschrieben. Das trifft
sicherlich für manche Enzyme zu, denn Formaldehyd reagiert mit Seitenkettenresten von Proteinen
wie -NH2, -OH und -SH, die allesamt am Aufbau von aktiven Zentren beteiligt sein können.
Bei der Urease kann man das nicht zeigen. Denn das Reaktionsprodukt der Urease-Reaktion,
Ammoniak, wird augenblicklich vom Formaldehyd addiert, ohne dass es seine "basischen Qualitäten"
ausspielen kann. Dabei bilden sich so genannter Aldehydammoniak und weiter Hexamethylentetramin
(Urotropin). Die Rötung der Reaktionslösung bleibt dann aus, obwohl sich Ammoniak gebildet haben
kann. Das kann man in einem Handversuch zeigen.
|
Versuch 4: Formaldehyd addiert Ammoniak
Ergebnis
|
Das zeigt wieder einmal, wie vorsichtig man sein muss, wenn es um die Planung von Versuchen und die Interpretation von Versuchsergebnissen geht!
Das aktive Zentrum der Urease
Bemerkenswert hinsichtlich der Hemmbarkeit durch Schwermetalle ist der Aufbau des aktiven
Zentrums. Hier befinden sich äußerst eng benachbart zwei
komplex gebundene Nickel(II)-Ionen, an die je ein Molekül Wasser
und Harnstoff gebunden sind (Bild 1). Die Metall-Ionen sorgen für exakte
sterische Ausrichtung der Moleküle der beiden Reaktionspartner Wasser und Harnstoff und
für die Polarisierung von Bindungen.
Bei der Reaktion spielen noch eine benachbarte Base und eine Säure eine wichtige Rolle:
Das Wassermolekül wird unter Einfluss der Base in ein Hydroxyl-Ion verwandelt, und
der Harnstoff wird am Sauerstoff durch die Säure protoniert. Dadurch wird sein C-Atom stärker
positiv geladen, das benachbarte OH-Ion kann nucleophil angreifen (Bild 2). Simultan spaltet ein
Ammoniakmolekül ab. Es entsteht die instabile Carbamidsäure NH2COOH, die spontan unter Bildung eines
weiteren Moleküls Ammoniak und Kohlenstoffdioxid zerfällt (Bild 3).
Nun kann das Enzym wieder mit einem Molekül Wasser und einem Molekül Harnstoff beladen werden,
und der Reaktionszyklus beginnt von neuem.
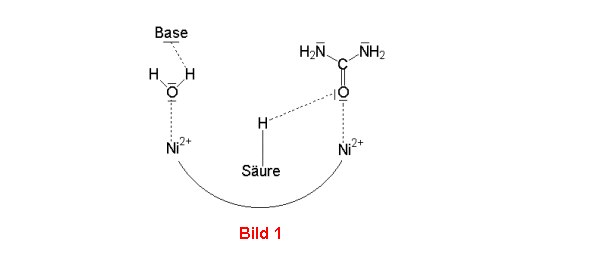
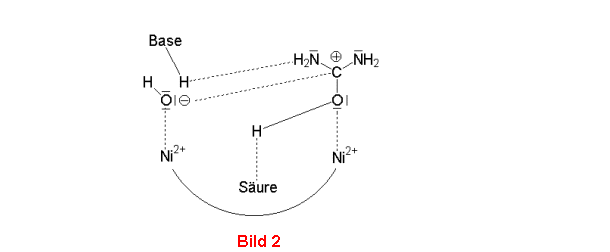
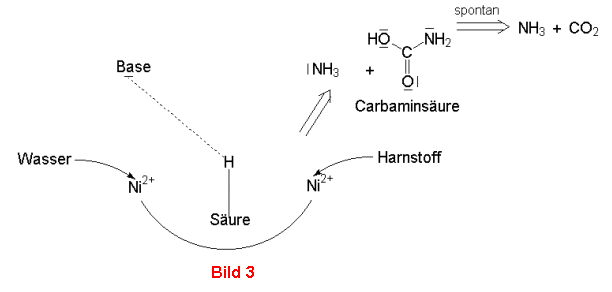
Bild 1-3: Mechanismus der Hydrolyse von Harnstoff durch die Urease
Letztlich findet die gleiche Reaktion statt, die bei der alkalischen Hydrolyse von Harnstoff
im Reagenzglas abläuft. Auch hier verdrängt ein OH-Ion (bzw. ein Wassermolekül)
ein Ammoniak-Molekül. Nur ist bei
der Urease die sterische Ausrichtung im aktiven Zentrum so optimal, dass alle Bindungen
simultan gelockert werden und damit die Aktivierungsenergie bedeutend verringert wird.
Deshalb ist die enzymatische Reaktion um den Faktor 1014 schneller als die
unkatalysierte.
Wie Thioharnstoff und andere Hemmstoffe wirken
Thioharnstoff hemmt den Umsatz von Harnstoff. Zur Untersuchung gibt man bei konstanter Harnstoffkonzentration
in jeweils neuen Ansätzen steigende Konzentrationen Thioharnstoff zu und misst jeweils den Umsatz des Harnstoffs.
Aus dieser Versuchsreihe folgt, dass es sich um eine Konkurrenzhemmung (kompetitive Hemmung)
handelt. Dieser Hemmtyp liegt vor, wenn die Moleküle zweier ähnlich gebauten Verbindungen um das aktive Zentrum konkurrieren,
wobei der hemmende Stoff nicht umgesetzt wird.
Dass Thioharnstoff im Gegensatz zu Harnstoff nicht umgesetzt wird, liegt nicht etwa an der unterschiedlichen Molmasse, sondern an der unterschiedlichen Elektronegativität von Sauerstoff (3,5) und Schwefel (2,5). Die Reaktion wird - wie die Graphik oben zeigt - eingeleitet, indem ein Proton an das stark elektronegative O-Atom des Harnstoffs andockt und in der Folge die CO-Bindung stark polarisiert wird. Eine solche Reaktion erfolgt beim weniger elektronegativen S-Atom nicht.
Vielleicht spielt auch die unterschiedliche Geometrie der beiden Harnstoff-Arten eine Rolle, denn im Gegensatz zu Sauerstoff bildet Schwefel kaum sp2-Hybrid-Orbitale.
Zu den anderen kompetitiven Hemmern wie N-Methylharnstoff sei gesagt, dass diese aufgrund des sperrigen Methylrests nicht mehr in die Tasche des aktiven Zentrums passen.
Bei der Substrathemmung rangeln zuviele Harnstoffmoleküle um die Bindungsstellen im aktiven Zentrum. Auch das verhindert die Folgereaktionen, die die eigentliche Hydrolyse bewirken.
Die Urease im Schul-Experiment
Qualitative Versuche zur Urease finden Sie hier. Auch zur praktischen
reaktionskinetischen Analyse des Enzyms mit Bestimmung des KM-Werts haben wir eine spezielle
Webseite.
Rüdiger Blume