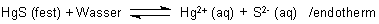
Löslichkeit von Salzen
Experimente:
Versuch: Löslichkeitsgleichgewicht schwerlöslicher Salze
Versuch: Schrittweise Verminderung der Konzentration von Blei-Ionen durch
verschiedene Fällungsreagenzien
Anhand der Löslichkeit von Salzen lässt sich
exemplarisch das chemische Gleichgewicht einführen
Wenn wir ein schwerlösliches Salz wie etwa Kalkstein in Wasser geben, bleibt im Allgemeinen
ein Bodensatz zurück, den wir auch durch gutes Schütteln und Rühren nicht auflösen können. Solch
eine Lösung mit Bodensatz bezeichnen wir als gesättigte Lösung. Der Grund für die Sättigung ist,
dass schwerlösliche Salze nur zum Teil dissoziieren.
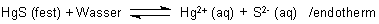
Es liegt ein chemisches Gleichgewicht vor. Die Gleichgewichtskonstante nennt man Löslichkeitsprodukt L. Es ist das Produkt aus den Konzentrationen der beteiligten Ionen; beispielsweise gilt für das Quecksilbersulfid:
LHgS = [Hg2+] · [S2-] (mol/l)2
Das Löslichkeitsprodukt ist ein Maß für die Löslichkeit eines Salzes. Je kleiner es ist, desto schwerer löslich ist der Stoff. So beträgt das Löslichkeitsprodukt des extrem schwerlöslichen Quecksilbersulfid HgS nur 10-54 (mol/l)2, das vom ebenfalls als sehr schwerlöslich geltenden Bleisulfat PbSO4 dagegen nur 10-8 (mol/l)2.
Es ist aber falsch anzunehmen, dass in dieser Lösung nichts mehr passiert! Könnten wir zuschauen,
so würden wir an der Oberfläche des Festkörpers ein ständiges Kommen und Gehen von Ionen beobachten.
Dabei löst sich genau so viel Salz wie sich wieder zurückbildet. Man sagt, dass hier ein
dynamisches chemisches Gleichgewicht vorliegt.
Dieses Gleichgewicht und damit der Wert von L
hängen besonders von der Temperatur ab. Erhitzt man eine Salzlösung mit Bodensatz, also eine
gesättigte Lösung, so löst sich das feste Salz mehr oder weniger auf. Kühlt man die so erhaltene
Lösung wieder ab, so entsteht eine übersättigte Lösung; der Bodensatz bildet sich wieder zurück.
(Hier erkennt man die Prinzipien von Le Chatelier wieder.) Lässt man besonders langsam abkühlen,
oder lässt man eine Lösung, die nicht gesättigt ist, langsam eindunsten, erhält man schöne
Salzkristalle. So werden Salzkristalle nicht nur gezüchtet, sondern so entstehen sie auch beim
Eindunsten der Meere.
Fällungs-Kaskaden
Wenn ein Ion verschiedene Salze unterschiedlicher Löslichkeit bildet, so kann man Fällungskaskaden
durchführen. Ein Beispiel sind die Blei(II)-Salze wie Chlorid, Iodid und Sulfid
(-> Versuch). Man gibt zur Lösung eines löslichen Bleisalzes wie Blei(II)-acetat
zunächst eine Chloridlösung, filtriert das Bleichlorid ab. Zum Filtrat setzt man dann eine Iodidlösung zu.
Man filtriert das Bleiiodid ab und versetzt das Filtrat mit Sulfidlösung. Es fällt Bleisulfid aus.
Dieser Versuchsverlauf lässt sich anhand der Löslichkeitsprodukte der beteiligten Salze erklären:
| PbCl2 | 1,6 · 10-5 |
| PbI2 | 8,3 · 10-9 |
| PbS | 7,0 · 10-29 |
Das Nacheinander der Ausfällung von Blei(II)-chlorid, Blei(II)-iodid und Blei(II)-sulfid zeigt, dass
auch nach den einzelnen Fällungen immer noch Blei(II)-Ionen in der Lösung vorhanden waren.
Am effektivsten ist die Fällung bei dem Salz mit dem kleinsten Löslichkeitsprodukt. Wenn man die Fällungs-Kaskade
umgekehrt durchführt, also zuerst Sulfid zugibt, beobachtet man natürlich keine Nachfällungen, weil das
Löslichkeitsprodukt des leichter löslichen Salzes nicht mehr erreicht wird.
Die Schwerlöslichkeit von Salzen wirkt sich auf die Umwelt
aus
Schwermetall-Ionen trennt man aus Abwässern grob durch Fällung als schwer
lösliche Salze ab. Dazu muss man Lösungs-Gleichgewichte einkalkulieren. Da der
Wert des Löslichkeitsprodukts konstant ist und nur von Temperatur und Druck abhängt,
kann man durch Erhöhung der Konzentration der einen Komponente die der anderen verringern.
Als Beispiel wählen wir das Bleisulfat:
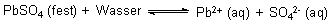
LpbSO4 = 10-8 (mol/l)2
LpbSO4 = [Pb2+] · [SO42-] = 10-4 mol/l · 10-4 mol/l
Es gilt eine ganz einfache Regel: Erhöht man [SO42-] auf 1 mol/l, also 100 mol/l, erniedrigt sich [Pb2+] auf 10-8 mol/l. Oder: Erhöht man die Konzentration der Sulfat-Ionen auf das Tausendfache, so erniedrigt sich die Konzentration der Blei-Ionen um genau eben diesen Faktor. Dieses ist auch eine Anwendung von Le Chateliers Prinzipien.
Die Menge an gelöstem Salz wird häufig unterschätzt, vor allem auch dann, wenn das Löslichkeitsprodukt scheinbar sehr klein ist und wenn dazu noch mehr als zwei Ionen am Lösungsgleichgewicht beteiligt sind. Ein Beispiel ist das schwerlösliche Bleichlorid mit L = 1,6 · 10-5 (mol/l)3 (20 °C).
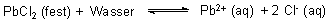
Wie viel Gramm von diesem Salz lösen sich in einem Liter Wasser?
L = cPb · cCl · cCl
Mit cCl = 2 cPb folgt
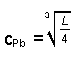
cPb = 1,59 · 10-2 mol/l
cCl = 3,18 · 10-2 mol/l
ßPb = cPb · MPb = 3,294 g/l
ßCl = cCl · MCl = 1,129 g/l
ßPbCl2 = 4,42 g/l
Die europäische Trinkwasser-VO (TVO 2001) schreibt für Blei den Grenzwert 10 µg/l vor. Eine bei Zimmertemperatur gesättigte Lösung von schwerlöslichem Bleichlorid ist mit ihrem Bleigehalt von 3,294 g/l um den Faktor 3,3 · 105 konzentrierter, als der Grenzwert zulässt, und ist entsprechend toxisch.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“