Allgemeines zum Kristallgitter von Kochsalz
Experimente:
Klicke hier

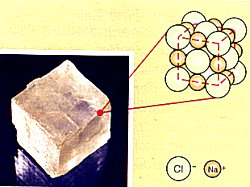
Kochsalzkristall und sein Aufbau aus Ionen
(Quelle: Cornelsen)
Ein Kristall besteht aus einer dreidimensionalen-periodischen Anordnung von Teilchen. Man
spricht von einem Kristallgitter oder auch Raumgitter.
Atome, Ionen oder Moleküle nehmen einen bestimmten Platz in diesem Gitter ein und werden durch die
Gitterkräfte zusammengehalten. Die Teilchen berühren einander, und der freie Raum
zwischen ihnen ist äußerst gering. Man spricht von dichten oder sogar von dichtesten Packungen.
Der kleinste Ausschnitt aus einem Kristallgitter ist die Elementarzelle.
Alle vorkommenden Teilchensorten nehmen in der Elementarzelle ihren festen Platz ein. Die Elementarzelle von Natriumchlorid
besteht aus 4 Natrium- und 4 Chlorid-Ionen. Dadurch lässt sich auch das
Gesetz der Winkelkonstanz erklären.
Um einen Kristall vollständig zu beschreiben, genügen Informationen aus einer einzigen Elementarzelle: Ihre
Abmessungen (Gitterkonstante), die Winkel und die Anordnung der Atome. Aus der Symmetrie der
Elementarzelle ergibt sich das Kristallsystem. Beim
Natriumchlorid handelt es sich um das Kubische System.
Die Teilchen in einem realen Kristall sind nicht starr angeordnet, sondern schwingen um ihren Mittelpunkt. Bei zunehmender Temperatur können die Schwingungen der Gitterbausteine so stark sein, dass die Gitterkräfte nicht mehr ausreichen, um den Kristall zusammenzuhalten. Je nachdem wie stark die Kräfte sind, bricht das Raumgitter bei 801 °C zusammen, d. h. der Kochsalzkristall schmilzt und wird in seine Ionen zerlegt.
Weitere Texte zum Thema „Salz“