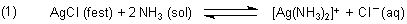
Silberchlorid ist in Ammoniakwasser löslich
Experimente:
Versuch: Silberchlorid löst sich in Ammoniak
Silberchlorid ist ein schwerlösliches Salz. Wenn man jedoch Ammoniak zugibt, scheint
es sich leicht aufzulösen (-> Versuch). Das nutzt man in der
qualitativen Analyse zur Bestimmung der Chlorid-Ionen aus.
Bei dieser Reaktion bildet sich der lösliche Di-Ammin-Silber-Komplex.
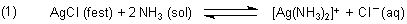
Wir sehen, dass es sich hier nicht um Auflösung des Niederschlags im physikalischen Sinne handelt, sondern um eine echte chemische Zersetzung.
Was ist der Grund für die Zersetzung?
Zur Erklärung des Phänomens muss man die Reaktion in zwei Schritte unterteilen. Zunächst
gibt es das Dissoziationsgleichgewicht des schwerlöslichen Salzes im Wasser.
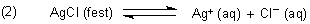
In Gegenwart des Ammoniaks schließt sich das Bildungsgleichgewicht des Di-Ammin-Silber-Komplexes an.
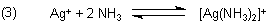
Die Silber-Ionen des Löslichkeitsgleichgewichts werden somit durch Komplexbildung entzogen. Das Salz zersetzt sich folglich.
Man kann diese Zersetzung von Silberchlorid in Ammoniaklösungen mit dem Schmelzen von Eis beim Streuen mit Salz vergleichen (Winterdienst). Auf dem Eis befindet sich luftdruckbedingt stets ein feiner Wasserfilm. Dieser wird ständig mit Hilfe des von außen hinzu kommenden Salzes abgelöst. Der Wasserfilm bildet sich kontinuierlich nach. Das hat zur Folge, dass das Eis schließlich ganz schmilzt und zu einer konzentrierten Natriumchloridlösung wird.
Weitere Texte zum Thema „Ammoniak, Amine und Säure-Amide“